- → Онтология → Философия химического взаимодействия и Философия биологической жизни → «Молекулы жизни»
-
3 закона абстрагирования
правила референции -
MS Access в анализе
основной инструмент -
На сайте
более 300 текстов -
Основания ценимости
«критика Блея», новый круг -
«Элементы истории»
попытка формализации
Огл. Некоторые основные химические концепции
Основы современной химии закладывались в конце XVIII столетия, когда после отказа от доктрин алхимии ученые начали использовать систематические наблюдения и количественные экспериментальные методы для исследования состава веществ из окружающего их мира. Сегодня химию можно определить как науку, изучающую структуру и состав различных веществ и тех превращений, которые происходят с этими веществами.
Химия — чрезвычайно широкая область исследований, охватывающая в известной степени также физику и биологию. Можно выделить три самостоятельных области: физическую химию, изучающую влияние таких физических свойств, как энергия и масса, на состав и превращения вещества; неорганическую химию, изучающую важнейшие свойства и структуру веществ и механизмы их превращений; органическую химию, изучающую свойства и реакции одного из основных элементов — углерода.
Органическая химия — это та часть химии, которая граничит с биологией, поскольку почти все вещества, образующие структуру живого организма, являются производными углерода. В последние годы на стыке химии и биологии возникла новая наука со своими собственными законами, называемая биохимией, и изучающая живые организмы с помощью химических методов. Биохимия исследует все соединения, образующие живой организм, и все те процессы, с помощью которых эти соединения включаются в состав структур, функций и систем, определяемых как «живые».
Из необъятного предмета биохимии как науки можно выделить структурную биохимию, которая исследует точную химическую структуру многих соединений, образующихся в живых организмах, и динамическую биохимию, изучающую химические изменения, называемые «метаболизмом». Данная книга посвящена структурным аспектам биохимии, составу и строению биологических соединений и путям, по которым они включаются в процесс образования живого организма. Однако понимание структурной биохимии требует знания некоторых основных химических законов, своеобразия химии углерода и некоторых понятий из органической химии. Этому-то и посвящены две первые главы книги.
Элементы и соединения. Материя Вселенной состоит примерно из ста простых веществ, называемых элементами; они не могут быть разложены никакими химическими способами на более простые вещества и не могут быть превращены одно в другое. Например, такой элемент, как кислород, не может быть расщеплен на более элементарные вещества и не может быть превращен в другие элементы, скажем, водород или свинец. Химики, как известно, обозначили каждый элемент специальным химическим символом, составленным из одной или двух букв, входящих в латинизированное название элемента. Так, кислород обозначается буквой O, водород — буквой H, углерод — C, свинец — Pb и т. д. Два или более элементов, реагируя, образуют химическое соединение, которое может быть разложено на составные элементы только с помощью химической реакции, но не физическим процессом типа разреза. Химические соединения изображаются в виде комбинации химических символов элементов. Например, вода, которая состоит из двух частей водорода и одной части кислорода, изображается как H2O, а распространенная поваренная соль, хлористый натрий, — как NaCl, где Na является символом натрия и Cl — символом хлора.
Атомы и молекулы. Наименьшее количество элемента, которое может существовать как элемент и которое еще обнаруживает вес характерные химические свойства этого элемента, называется атомом. В настоящее время, конечно, атом может быть расщеплен на более мелкие частицы, однако последние уже не будут больше обнаруживать свойства элемента. Аналогично наименьшее количество соединения, еще обладающее его характерными свойствами, называется молекулой. Молекула состоит из двух и более атомов. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, молекула поваренной соли — из атомов натрия и хлора. Иногда два или более атомов одного и того же элемента объединяются с образованием молекулы. Например, каждая молекула кислорода иди водорода образована из двух атомов элемента и поэтому изображается в виде O2 и H2.
Атомы — очень малые частицы. Например, диаметр атома водорода около одной десятимиллионной миллиметра. Некоторое представление о такой величине дает следующий факт: 56 г элемента железа содержат 602 000 000 000 000 000 000 000 атомов. Если бы каждый атом был величиной с горох, то этого количества хватило бы, чтобы покрыть поверхность земного шара слоем толщиной 150—180 метров.

Рис. 1. Раннее представление о структуре атома как о твердой сфере (слева); модель «пудинга» (в центре); современное представление — ядро, вокруг которого вращаются электроны (справа)
Вследствие того, что микроскопическая частица вещества содержит такое большое число атомов, можно было бы предположить, что атомы представляют собой твердые, далее неделимые сферические частицы. Так и считали древние философы. На самом деле атомы состоят из гораздо более мелких частиц, называемых протонами, нейтронами, электронами, и большая часть атомного объема представляет собой как бы пустоту.
Строение атома. Строение атома долгое время оставалось загадкой для ученых. Даже после доказательства существования электронов как субатомных частичек, ученые все еще не расставались с идеей твердых сферических частиц. Была выдвинута теория, что атом подобен пудингу с изюмом — положительный заряд распределен равномерно по всему объему атома, а электроны, подобно изюминам, как бы вкраплены в эту сферу. Позже было доказано, что в атомах имеется небольшая очень плотная область, гораздо более плотная и с гораздо более высокой концентрацией положительного электрического заряда, чем это можно было бы объяснить на основе модели «пудинга». Была выдвинута новая теория, предполагающая, что атом подобен Солнечной системе: почти вся масса сконцентрирована в центральной его части —ядре (подобно солнцу), а вокруг ядра по орбитам вращаются электроны (подобно планетам). Тот факт, что орбиты электронов проходят далеко от ядер, означал, что большая часть объема атома является пустым пространством, как и в Солнечной системе, в которой ограниченное число планет находится в колоссальном объеме пространства. Хотя к настоящему времени эта модель существенно модифицирована, она широко используется, в том числе и биохимиками (рис 1)

Рис. 2. Строение некоторых простых атомов. Число электронов на внешней орбите определяет валентность элемента
Ядро атома состоит из небольших частиц — протонов и нейтронов. Оба вида частиц имеют примерно одинаковую массу, однако протон несет положительный электрический заряд, нейтрон электронейтрален. Нейтроны обычно присутствуют в ядрах в несколько большем количестве, чем протоны. Электрон несет электрический заряд, противоположный заряду протона, однако равный ему по величине. Масса электрона составляет только 1/1836 массы протона. Атомы различных элементов отличаются тем, что содержат разное число этих субатомных частичек, но в каждом атоме число протонов всегда равно числу электронов, поэтому атом в целом электронейтрален.

Рис. 3. Периодическая система элементов (показаны только первые четыре периода поскольку именно в этих периодах находятся почти все элементы, входящие в состав важных для биохимии соединений)
Наименьший и простейший из всех атомов — атом водорода, в его состав входит один протон и один электрон, а нейтроны отсутствуют. Гелий, второй из простейших атомов, имеет ядро, состоящее из двух протонов и двух нейтронов, а также два электрона на орбите. Следующий элемент, литий, обладающий свойствами металла, имеет три протона и четыре нейтрона в ядре, а также три орбитальных электрона. Число протонов в ядре любого атома называется его атомным номером, и по мере перехода к более тяжелым и более сложным атомам атомный номер растет. Самые тяжелые элементы содержат около сотни протонов и электронов и несколько больше нейтронов (рис.2). Периодическая система элементов. Уже в середине XIX столетия было известно, что определенные группы элементов имеют сходные свойства, например: литий, натрий и калий — высоко реакционноспособные мягкие металлы, а хлор, бром и йод — ярко выраженные неметаллы. После разнообразных попыток объяснить это явление было обнаружено, что если расположить элементы в порядке возрастания их атомных номеров, а потом разделить этот непрерывный ряд на группы из восьми элементов (начиная с лития, так как водород и гелий не вписываются в схему), то возникает определенная стройная схема. Она называется теперь Периодической системой элементов Д. И. Менделеева. Все элементы, расположенные друг под другом в вертикальном ряду системы элементов, называемом группой, имеют сходные химические свойства. Так, литий, натрий и калий, о которых говорилось выше, расположены в одной группе, а хлор, бром и йод — в другой. В горизонтальных рядах, называемых периодами, свойства элементов тоже изменяются в определенной последовательности. Например, натрий, магний и алюминий — металлы, а кремний, фосфор, сера и хлор — неметаллы; последний элемент в этом ряду, аргон, — инертный газ. Определенное число элементов, называемых переходными, не подходило под эту простую схему, и периодическая система элементов была впоследствии несколько модифицирована (рис. 3).
Кроме подобия в свойствах определенных элементов, из периодической системы элементов можно получить и большую информацию относительно поведения элементов в химических реакциях. Элементы располагаются в порядке возрастания их атомных номеров, а, следовательно, и в порядке возрастания числа электронов, поскольку последнее равно числу протонов. А число электронов в атоме, в основном, и определяет поведение этого атома при взаимодействии с другим атомом.
Электроны в атоме занимают определенные орбиты, или так называемые оболочки, вокруг ядра, и каждая электронная оболочка может содержать определенное число электронов. Первая оболочка удерживает до двух электронов. Если атом содержит более двух электронов, то третий, четвертый и т. д. электроны занимают следующую оболочку, которая, в свою очередь, может содержать только восемь электронов; в атомах с числом электронов более девяти появляется третья оболочка и т. д. Для реакционной способности атомов наиболее важными являются как раз наиболее удаленные, частично заполненные внешние электронные оболочки, называемые валентными. В периодической системе все элементы одной и той же группы имеют равное число электронов на внешней валентной оболочке. У лития, натрия и калия по одному электрону на внешней оболочке, а у хлора, брома и йода — по семь электронов.
В каждом горизонтальном ряду число валентных электронов возрастает постепенно с увеличением атомного номера. Валентные оболочки всех без исключения элементов, стоящих в конце каждого периода, заполнены. Это означает, что все эти элементы чрезвычайно стабильны, инертны (они так и называются инертными, или благородными, газами).

Рис. 4. Образование ионной связи между атомами натрия и хлора (вверху). Ковалентные связи в молекуле метана образуются путем обобщения пары электронов (внизу)
Ионная и ковалентная связи. При взаимодействии двух атомов, а именно их электронов, образуется молекула. Каждый из реагирующих атомов стремится достигнуть такого состояния, когда внешняя валентная оболочка будет соответствовать оболочке инертного газа, поскольку именно эта электронная структура обеспечивает значительно более высокую стабильность (рис. 4). Например, атом натрия имеет только один электрон на валентной оболочке. Если у него появляется возможность отдать этот единственный электрон, то валентная оболочка оказывается свободной, а следующая, внутренняя, оболочка становится как бы внешней. Она теперь заполнена до предела, подобно электронной структуре инертного газа неона. Хлор, наоборот, имеет семь электронов на внешней оболочке, и если у него появляется возможность получить один электрон с оболочки другого атома, то он стремится заполнить свою оболочку, чтобы она напоминала внешнюю оболочку инертного газа аргона. Таким образом, атом натрия и атом хлора могут «объединить усилия», когда атом натрия отдает электрон атому хлора, и оба атома «выигрывают» от этого. Действительно, при взаимодействии натрия и хлора имеет место бурная реакция с образованием хлористого натрия (поваренной соли).
Что же происходит, когда атомы теряют свою электронейтральность? Атом натрия, потерявший электрон, имеет на один положительно заряженный протон больше, поэтому он несет положительный заряд и является положительно заряженным ионом, или катионом (Na+). Хлор, принявший один электрон, имеет избыток электронов относительно числа протонов и становится отрицательно заряженным ионом — анионом (Cl—). Согласно известному закону физики, оба противоположно заряженных иона притягиваются друг к другу. Однако, сблизившись до известного предела, они останавливаются на таком расстоянии, при котором притяжение уравновешивается взаимным отталкиванием их электронных оболочек. Валентная связь, сопровождающаяся полным перетягиванием электрона одним из атомов, называется ионной связью.
Как правило, элементы из правой части периодической системы элементов (с более чем четырьмя электронами на внешней валентной оболочке) стремятся захватить электроны с образованием анионов, а элементы из левой части периодической системы (с менее чем четырьмя электронами на внешней валентной оболочке) стремятся отдать электроны с образованием катионов. Перенос электронов от одного атома к другому требует затраты определенного количества энергии, тем большего, чем большее число электронов отдается или принимается.
Имеется и другой тип химической связи, когда два атома «совместно» владеют одними и теми же электронами, при этом у каждого атома валентная оболочка имеет электронную структуру инертного газа. Такой тип химической связи обычно осуществляется между одинаковыми атомами или между атомами элементов, занимающих место в верхнем правом углу периодической системы элементов, и называется ковалентной. Ковалентная связь образуется парой электронов, каждый из которых поставляется атомом, образующим связь; эта обобщенная пара электронов ведет себя так, будто она присутствует в одно и то же время на электронных оболочках обоих атомов. Так, два атома хлора, каждый в отдельности, могут принимать участие в образовании ковалентной связи одним из своих семи валентных электронов. Поэтому на внешней оболочке каждого атома имеется по шесть валентных электронов плюс пара электронов, в равной степени принадлежащая обоим атомам. Такая электронная структура подобна внешней оболочке инертного газа аргона. Результатом обобщения электронов является образование молекулы хлора Cl2. Каждый из двух атомов водорода может отдать свой единственный электрон для образования ковалентной связи, и на валентных оболочках обоих атомов будет по два электрона, так же, как у другого инертного газа — гелия; именно так образуется молекула водорода H2.
У углерода на внешней валентной оболочке имеются четыре электрона, поэтому образование ионных связей с переносом четырех электронов мало вероятно по энергетическим соображениям; углерод при взаимодействии с другими атомами почти всегда образует ковалентные связи (см. рис. 4).
Число электронов, которое один атом может принять или отдать с образованием ионной связи или обобщить с образованием ковалентной связи, называется валентностью этого атома. Так, хлор при образовании связи может принять один электрон от другого атома и станет одновалентным. Аналогично водород может участвовать в образовании связи только одним электроном и поэтому тоже является одновалентным. Углерод способен участвовать в образовании ковалентной связи четырьмя электронами и поэтому имеет валентность, равную четырем, т. е. он четырехвалентен. Другими словами, валентность атома — это его способность к взаимодействию с другими атомами, выраженная числом водородных или других одновалентных атомов.
Атомные массы. Элементы состоят из атомов с различным числом протонов и нейтронов в ядре, поэтому каждый определенный атом имеет свою массу. Хотя в известном смысле было бы правильнее оперировать абсолютными массами атома, последняя слишком мала для практического использования. Так, масса атома водорода составляет всего 1,67-10-24 г. Поэтому первоначально была разработана стандартная шкала, по которой масса атома водорода была принята за единицу, а атомные массы всех других элементов были выражены в этих условных единицах. По этой шкале атомная масса атома кислорода равна 16, углерода — 12, натрия — 23 и т. д.
В настоящее время за стандарт принята 1/12 часть массы атома углерода. По этой шкале атомная масса водорода равна 1,008 единиц (единица атомной массы обозначается а. е. м.), а для натрия — 22,9898 а. е. м. Молекулярные массы, т. е. массы молекул, образованных двумя или более атомами, рассчитываются путем сложения всех атомных масс атомов, составляющих молекулу. Молекулярная масса молекулы водорода равна 2,016, поскольку в молекуле два атома водорода. Для метана она соответствует 16,032, как сумма атомных масс одного атома углерода и четырех атомов водорода.
Кислоты и основания. В последних главах книги, в которых описываются сложные и разнообразные биохимические соединения, принимающие участие в построении живого организма, постоянно будут использоваться термины «кислоты», «основания», «соли», а также анализироваться основные химические реакции, называемые окислением и восстановлением, поэтому целесообразно кратко объяснить эти термины. Уже в средние века алхимики различали две группы соединений. Одна группа, называемая кислотами, включала соединения, имеющие кислый вкус, растворяющие металлы и способные изменять цвет растворов, приготовляемых из растительных материалов (индикаторов). Другая группа соединений, называемая основаниями, имела солоноватый вкус, растворяла только небольшое количество определенных металлов, и, будучи добавленной к раствору индикаторов, изменяла их цвет в другой, чем кислоты. Алхимики обнаружили также, что основания реагируют с кислотами, образуя соединения, которые не имеют ни кислых, ни основных свойств (характерного вкуса, способности растворять металлы или изменять цвет индикаторов); такие соединения были названы солями.
Деление соединений на кислоты и основания используется до сих пор, хотя теперь критерием принадлежности соединения к той или иной группе служат не внешние признаки. Сейчас кислотой называют вещество, которое в растворе диссоциирует на ионы, один из которых —ион водорода H+ (протон). Примером кислоты является хлористый водород, который при растворении в воде диссоциирует на ион хлора Cl- и протон H+.
Основания — это вещества, которые принимают протоны от внешнего источника. Так, аммиак, соединение азота и водорода NH3, является основанием, поскольку в водных растворах он может принимать протон с образованием иона аммония NH4+. Основания можно определить также как вещества, которые в растворах диссоциируют с образованием ионов гидроксила ОН-.
Когда основание реагирует с кислотой, то происходит реакция нейтрализации, в результате которой образуются соль и вода. При взаимодействии хлористого водорода с гидроокисью калия в растворе протон и ион гидроксила образуют воду, а ионы калия и хлора остаются в растворе. Если этот раствор выпарить, то осадок будет содержать соль KCl, в которой ионы калия и хлора удерживаются ионными связями. Все ионные соединения при растворении в воде диссоциируют на ионы. Эти соединения называют электролитами (рис. 5).

Рис. 5. При пропускании электрического тока через раствор электролита ионы перемещаются в направлении электродов
Кислотность растворов — очень важная характеристика как в органической химии, так и в биохимии. Она измеряется концентрацией ионов водорода в растворе и выражается по шкале, называемой pH-шкалой. Значение pH раствора определяется путем измерения концентрации ионов водорода, затем берется логарифм этого значения с обратным знаком. Нейтральные растворы, которые не являются ни кислыми, ни основными, имеют значение pH, равное семи. Кислоты имеют значительно более высокую концентрацию водородных ионов, поэтому значения pH для них меньше семи; у сильных кислот pH около единицы. Сильные основания имеют значительно более низкую концентрацию водородных ионов, поэтому значения pH для них выше семи (обычно около тринадцати). Слабые кислоты и основания, которые не диссоциируют полностью, имеют значения pH порядка шести и восьми соответственно. Чистая вода и растворы большинства солей нейтральны, поэтому у них pH равно семи.
Окисление и восстановление. Имеются разнообразные определения обоих типов реакций. Окисление может быть определено как присоединение кислорода к веществу или отщепление водорода от вещества, а восстановление, наоборот, — как потеря кислорода или присоединение водорода. Более общим является определение, согласно которому окисление представляет собой потерю электрона атомом или ионом, восстановление — присоединение электрона. Таким образом, когда атом хлора присоединяет электрон и превращается в ион хлора, происходит реакция восстановления, а когда атом натрия теряет электрон и превращается в ион натрия, происходит реакция окисления. Во всех случаях реакции окисления должны сопровождаться реакциями восстановления, и в приведенных примерах при взаимодействии атомов натрия и хлора должны образоваться ионы как того, так и другого элемента.
Теперь, после ознакомления с основами химии — строением атомов и путями образования из них молекул — можно перейти к рассмотрению элемента углерода, основного элемента органической химии, и к обсуждению вопроса, как и почему этот элемент образует такое разнообразное число органических соединений.
Огл. Химия углерода
Структурная биохимия зародилась в середине XVIII века, когда ученые еще только пытались узнать состав и функции живых организмов. Естественно, что вследствие сложности проблем, связанных с исследованием химических соединений и их реакций в живых организмах, решение всех этих вопросов стало возможным только с развитием теории химии и специальных методов исследования.
Начальным толчком к развитию структурной биохимии послужили, безусловно, работы шведского химика Карла Шееле, который в середине XVIII столетия выделил ряд природных соединений из животных и растительных тканей. В начале XIX века в лабораториях Йонса Берцелиуса и Юстаса Либиха были разработаны количественные методы элементного анализа, показавшие, что все природные вещества содержат в своем составе углерод. Были сделаны попытки получить эти соединения синтетическим путем из простых элементов и соединений.
Однако в то время считали, что синтез природных соединений «в пробирке» практически невозможен и что такие соединения могут быть получены только в живых организмах с помощью «жизненной силы». Эта теория так и называлась витализмом, а те вещества, которые могли быть получены только из живых организмов, описывались как «органические». Теория витализма была опровергнута в 1828 г., когда Фридрих Вёллер из простых неорганических соединений синтезировал мочевину (составная часть мочи млекопитающих). Вёллер пытался синтезировать циановокислый аммоний из цианистого калия и сульфата аммония, но вместо этого выделил мочевину, показав тем самым, что органические вещества отличаются от неорганических только своим составом, и что они обязаны своими специфическими свойствами присутствию в них атомов углерода, а вовсе не жизненной силе. Вслед за работой Вёллера последовал синтез уксусной кислоты, осуществленный Адольфом Кольбе в 1844 г., а затем Марселин Бертло в 1850 г. синтезировал несколько других органических веществ. Витализм как теория прекратил свое существование, но термин «органическая химия» используется до сих пор для описания химии соединений углерода. А под термином «биохимия» понимают описание химических веществ, входящих в состав живого организма.
Химия углерода. Углерод является основным элементом для биологически важных соединений. Уникальная способность углерода образовывать огромное число разнообразных соединений (число известных органических соединений значительно превышает число соединений всех остальных элементов периодической системы) обязана вовсе не его распространенности в земной коре, а возможности образовывать химическую связь углерод — углерод. Способность эта, по-видимому, безгранична, так как известны очень длинные молекулы, цепочки которых содержат многие десятки и даже сотни атомов углерода. Углеродные цепочки чрезвычайно устойчивы и разорвать их нелегко. Другой элемент — кремний — в семьдесят пять раз более распространен в земной коре; хотя он и образует сам с собой химическую связь (кремний —кремний), такие молекулы гораздо менее стабильны, и в состав цепочки не может входить больше чем несколько атомов кремния. Поэтому число соединений кремния составляет только небольшую долю от числа углеродных соединений.

Рис. 6. Четыре ковалентные связи атома углерода направлены к четырем углам правильного тетраэдра (слева). Если все четыре связи заняты атомами водорода, то образующаяся молекула называется метаном. Если два атома углерода, каждый из которых имеет тетраэдрическую форму, соединены друг с другом, то молекула называется этаном
Есть еще и другое свойство у углерода, объясняющее наличие такого большого числа его соединений, — это его способность соединяться с другими элементами, такими, как водород, кислород и азот, с образованием высокоустойчивых соединений. Соответствующие кремниевые соединения не столь прочны и часто не могут существовать в виде простых одиночных молекул. Например, двуокись кремния имеет тенденцию к образованию крупных агрегатов молекул, чтобы обрести устойчивое состояние, в то время как соответствующее соединение углерода (двуокись углерода) чрезвычайно стабильно и в виде отдельной молекулы.
Согласно положению в периодической системе элементов, углерод имеет атомный номер шесть, следовательно, у него шесть электронов. Два из них заполняют первую электронную оболочку, а четыре остальных находятся на внешней, валентной незаполненной оболочке и поэтому могут образовывать химические связи с другими атомами. Атом углерода четырехвалентен, н способен к образованию четырех ковалентных связей с атомами водорода или их эквивалентом. Поскольку ковалентные связи образуются в результате обобщения пары электронов, они всегда имеют определенную пространственную ориентацию относительно центрального атома. У углерода четыре связи расположены так, что они направлены в четыре угла правильного тетраэдра, в центре которого находится сам атом углерода.
Алифатические углеводороды. Метан CH4 — простейший представитель большого класса органических соединений, называемых углеводородами, которые, как это следует из самого названия, содержат только углерод и водород. Если один из атомов водорода в метане заместить на другой атом углерода, который в свою очередь связан с тремя атомами водорода, то получится молекула следующего члена этого ряда — этана СН3СН3, тоже газа (рис. 6). Углеводороды, содержащие атомы углерода, связанные вместе в длинные цепочки, называются алифатическими углеводородами.
Следующий углеводород данного ряда содержит три атома углерода, соединенных друг с другом так, как будто один из атомов водорода в этане замещен на атом углерода с тремя атомами водорода. Каждый атом углерода на конце этой цепочки имеет по три атома водорода, а атом углерода в середине цепочки, связанный с двумя другими атомами углерода ковалентной связью, имеет только два атома водорода. Поэтому этот третий углеводород, называемый пропаном, изображается как СН3СН2СН3. Аналогично четвертый член ряда, бутан, изображается как СН3СН2СН2СН3.
Можно заметить, что число атомов водорода у каждого представителя этого класса соединений всегда вдвое больше числа атомов углерода плюс два, поэтому общая формула для них СnН2n+2, где n — число атомов углерода в цепи. Так, если у углеводорода шесть атомов углерода, то он должен иметь (2x6)+2, т, е. 14 атомов водорода и его можно изобразить как СН3СН2СН2СН2СН2СН3.
Такая группа соединений, которая имеет общую формулу и в которой каждый последующий член отличается от предыдущего на один атом углерода и соответствующее количество атомов водорода, называется гомологическим рядом, а его члены — гомологами. Члены гомологического ряда, в котором молекулы содержат максимально возможное число атомов водорода для данного числа атомов углерода, называются алканами; говорят, что гомологи этого ряда «насыщены» атомами водорода.
Группирование соединений в гомологические ряды значительно упрощает структуру органической химии. Интересной особенностью гомологического ряда является то, что химические и физические свойства каждого члена отличаются от предыдущего, и эти отличия становятся заметнее по мере возрастания молекулярной массы гомолога. Так, в ряду алканов первые несколько членов — газы. Бутан, углеводород с четырьмя атомами углерода, является жидкостью с очень низкой температурой кипения; по мере того, как углеродная цепь становится длиннее, температуры кипения соединений этого ряда растут. При достижении определенной длины углеродной цепи соединения становятся твердыми, а по мере дальнейшего роста углеродной цепи температуры плавления твердых углеводородов возрастают.
Во всех соединениях углерода, которые рассматривались до сих пор, каждый атом углерода так соединялся с четырьмя другими атомами водорода или углерода, что только одна пара электронов участвовала в образовании каждой связи. Иная ситуация возникает тогда, когда углерод соединяется с таким атомом, как кислород. Кислород, как это следует из периодической системы элементов, имеет шесть электронов на валентной оболочке; он двухвалентен, т. е. один атом кислорода может присоединить два атома водорода. Атом углерода может присоединить только два атома двухвалентного кислорода (вместо четырех атомов одновалентного водорода). Поэтому каждая связь между углеродом и кислородом может быть образована обобщением двух пар электронов (два электрона от углерода и два — от кислорода). Между такими двумя атомами возникает двойная ковалентная связь. Один атом углерода может связывать два атома кислорода, образуя две двойных связи, как это имеет место в молекуле окиси углерода.
Совсем иная картина наблюдается, когда атом углерода соединяется с таким атомом, как азот, имеющим валентность три (на внешней оболочке азота находится пять электронов, на три меньше, чем у соответствующего инертного газа). Химическая связь между атомом углерода и атомом азота — тройная, включающая три пары электронов (три от углерода и три от азота). У атома углерода еще остается один электрон на валентной оболочке, с помощью которого он может образовать одну ковалентную связь с каким-либо другим одновалентным атомом.
Молекулы, содержащие двойные и тройные связи, имеют плоскую двухмерную структуру, совершенно отличную от трехмерной структуры молекулы метана.
Атом углерода может образовывать двойные (или тройные) ковалентные связи с другими атомами углерода аналогичным путем, т. е. обобщением двух (или трех) пар электронов. Если два атома углерода соединяются с образованием двойной связи, каждый атом еще имеет по два валентных электрона для образования ковалентных связей с атомами водорода. Такая молекула, называемая этиленом CH2=CH2, является простейшим членом другого гомологического ряда углеводородов, называемых алкенами. Длинные цепи углеродных атомов могут образовываться и в этом случае, причем в цепи будет находиться одна или более двойных связей. Присутствие двойной связи означает, что молекула в целом содержит меньше атомов водорода, чем молекула углеводорода, в которой равное число атомов углерода соединены только одинарными связями. Про эти соединения говорят, что они не насыщены атомами водорода, т. е. число атомов водорода не является максимально возможным для данного числа атомов углерода.
Атомы углерода, соединенные тройной связью, образуют новый гомологический ряд углеводородов. Простейший член состоит из двух атомов углерода, соединенных тройной связью. Поэтому у него только два атома водорода, так как у каждого атома углерода после образования тройной связи остается только один электрон на валентной оболочке. Такую молекулу называют этин (чаще более старым названием — ацетилен), а вся эта серия углеводородов называется алкинами. Они, естественно, являются в значительно большей степени ненасыщенными углеводородами, чем алкены (рис. 7).
До сих пор рассматривались только углеводороды, состоящие из прямой цепи атомов углерода, т. е. такой, в которой в один атом углерода не связан больше, чем с двумя другими атомами углерода; однако последние могут соединяться и иным путем. Например, четыре атома углерода могут объединяться с образованием цепи из трех атомов, а четвертый может присоединиться к среднему атому углерода с образованием боковой ветви. Углеводороды такого типа называют углеводородами с разветвленной цепью. Если подсчитать число атомов водорода и углерода в разветвленной молекуле, то оно окажется точно таким же, как и в соответствующей молекуле с прямой цепью. В указанном примере общее число атомов водорода равно десяти, так же как и в бутане с прямой углеродной цепью. По мере увеличения числа атомов углерода в цепи появляется все больше возможностей для разветвления, однако во всех случаи общая формула и прямоцепочечных (нормальных), и разветвленных насыщенных углеводородов остается СnН2n+2.
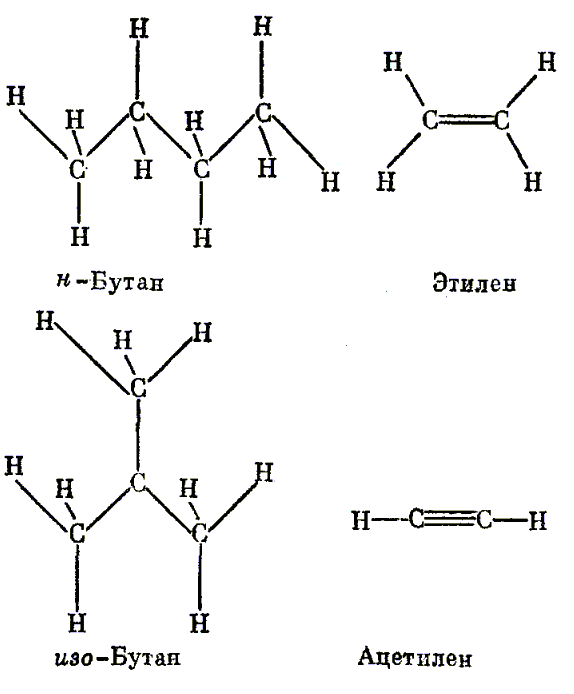
Рис. 7. Четыре атома углерода могут соединяться друг с другом, образуя либо прямую цепь (вверху слева), либо разветвленную (внизу слева). Атомы углерода могут соединяться двойной (вверху справа) или тройной связью (внизу справа)
Углеводороды с прямой или разветвленной цепью, хотя и с одним и тем же числом атомов углерода и водорода, естественно, не имеют одинаковой структуры. Они являются различным соединениями с различными химическими и физическими свойствами. Соединения с одним и тем же числом атомов в молекуле, но с различной структурой называются структурными изомерами. Например, бутан существует в виде двух структурных изомеров; разветвленный изомер бутана (изо-бутан) изображается как СН3СН(СН3)—СН3. Молекула пентана СН3СН(СН2СН3)-СН3 может иметь разветвление из двух атомов углерода. Формулы приведенные выше, являются структурными формулами, поскольку они отражают структуру молекулы (скобки указывают на наличие ветви), в то время как формулы С4Н10 для бутана или С5Н12 для пентана называются эмпирическими формулами, так как они отражают только общее число атомов в молекуле.
Циклические и ароматические углеводороды. Атомы углерода могут соединяться и таким образом, что вместо прямой или разветвленной цепи образуется цикл. Простейшие циклические структуры, образованные из атомов углерода с помощью простых связей, — производные алканов. Такие молекулы могут быть представлены общей эмпирической формулой СnН2n; они имеют на два атома водорода меньше по сравнению с прямоцепочечными молекулами, так как каждый атом углерода связан с двумя другими атомами углерода в кольце и может удерживать только два атома водорода. Это и определяет максимальное количество атомов водорода в структуре так называемых циклоалканов, которые являются насыщенными углеводородами. Возможно также объединение двух или более таких углеродных колец с образованием бициклоалканов и трициклоалканов.
Гораздо более важны в органической химии циклические структуры — производные от соединения, называемого бензолом. Такие соединения называются ароматическими углеводородами по той причине, что первые из полученных представителей этого класса соединений обладают характерным приятным ароматом.
Бензол — простейший из ароматических углеводородов — имеет шестичленную циклическую структуру из атомов углерода. Эмпирическая формула бензола — С6Н6, следовательно, он — ненасыщенное соединение. Обычно его молекулу изображают в виде плоского правильного шестиугольника с атомами углерода по углам, соединенными между собой поочередно простыми и двойными связями. Такая структура для бензола была предложена в 1865 г. немецким химиком Августом Кекуле, и она согласуется со всеми физическими и химическими свойствами этого соединения, известными в настоящее время (рис. 8). Однако оказалось, что такое изображение бензола не совсем точно: на самом деле каждый атом углерода соединен с другим атомом углерода связью, которая является «гибридной» между простой и двойной связью, так что все шесть связей в структуре равноценны. Однако для целей данной книги традиционное изображение бензольной молекулы вполне достаточно.
Структуры из ароматических колец могут объединяться друг с другом, как и циклоалканы, образуя ароматические соединения бициклического, трициклического ряда и т. д. Бензольная структура, а также примеры прямых и разветвленных цепей углеводородов и циклоалканов представлены на рис. 7 и 8.

Рис. 8. Циклогексан является насыщенным, а бензол — ненасыщенным соединением; для удобства оба типа колец изображают, как это показано справа, без указания атомов углерода в кольце
Функциональные группы. Углеводороды составляют огромное число органических соединений, они в той или иной форме входят в состав многих биохимических соединений. Однако круг органических и биохимических соединений не ограничен только простыми углеводородами: существует большое количество их производных, в состав которых входят другие элементы, чаще всего кислород и азот. Обычно производные углеводородов представляют собой вещества, молекулы которых состоят из двух частей: углеводородных остатков и функциональных групп, которые в основном определяют химические свойства вещества и в состав которых входят неуглеродные атомы. Именно эти группы определяют принадлежность вещества к определенному классу соединений.
Так, органические соединения, в состав которых входит гидроксильная группа OH, называют спиртами. Наиболее известный член этого класса соединений — этиловый спирт, содержащийся в пиве, вине и других спиртных напитках. Спирты можно рассматривать как углеводороды, в которых один из атомов водорода замещен на гидроксильную группу. Различают три положения гидроксила в углеродной цепи. Первичные спирты имеют общую формулу RСН2—ОН, гидроксильная группа присоединена к конечному атому углерода цепи. В последующих главах и рисунках книги буквой R обозначен углеводородный заместитель, так называемый радикал (если его состав не имеет существенного значения при обсуждении конкретной проблемы). Вторичные спирты имеют формулу RCH(OH)R¢ ; в этом случае гидроксильная группа замещает атом водорода при одном из средних атомов углерода прямой цепи. Третья группа, третичные спирты, имеют формулу RR¢ R¢¢ C-OH¢, и в этом случае группа OH находится у атома углерода, который образует разветвление в цепи углеводорода. Все обсуждаемые типы спиртов представлены на рис. 9.
Спирты с короткой углеводородной цепью — жидкости, растворимые в воде. Спирты с более длинной цепью при комнатной температуре представляют собой твердые тела и нерастворимы (или слабо растворимы) в воде. Члены этого класса также образуют гомологический ряд — их свойства изменяются постепенно с изменением длины молекулы. Так, растворимость всех гомологов, в общем случае, падает с увеличением длины углеводородной цепи, и при достижении определенной длины соединение становится вообще нерастворимым. Это свойство будет отмечаться неоднократно при обсуждении биохимически важных соединений. Спирты можно классифицировать также согласно числу гидроксильных групп, содержащихся в молекуле. Они могут быть соответственно одноатомными, двухатомными н трехатомными спиртами.Функциональные группы, например спиртовая, могут замещать атом водорода и в бензольном ядре, образуя соединения, называемые фенолами. Фенолы и их производные в небольшой степени диссоциируют на отрицательно заряженный органический ион и протон. Они являются слабыми кислотами, раньше фенол так и называли — карболовая кислота.
Функциональная группа, состоящая из атома углерода, соединенного двойной связью с атомом кислорода, называется карбонильной группой C=O. Атом углерода в такой группе имеет еще два валентных электрона, способных образовывать связи с другими атомами или группами атомов, и в зависимости от того, к чему присоединена эта группа, различают два класса соединений. Если атом углерода карбонила связан с двумя другими атомами углеродной цепи, т.е. если карбонильная груши расположена в середине цепи, то образующиеся соединения называют кетонами. Если атом углерода карбонила соединен с атомом углерода и атомом водорода, т. е. эта группа находится на конце углеродной цепи, то образующиеся соединения называет альдегидами.

Рис. 9. Наиболее распространенные функциональные группы, встречающиеся в важных для биохимии соединениях; R, R¢ и R¢¢ обозначают остальную часть молекулы, обычно углеводородную цепь
Функциональную группу, в которой атом углерода соединен двойной связью с атомом кислорода и одинарной связью с гидроксильной группой, называют карбоксильной; соединения, содержащие эту функциональную группу, образуют большой класс карбоновых, или просто органических, кислот. Наличие карбонильной и гидроксильной групп при одном и том же атоме углерода определяет свойства этих соединений. Так, входящая в состав карбоксила карбонильная группа не обнаруживает реакций, присущих альдегидам и кетонам, а гидроксильная группа ионизуется в гораздо большей степени по сравнению с такой же группой в спиртах или фенолах. Атом водорода карбоксильной группы может диссоциировать, в результате чего карбоксильная группа получает отрицательный заряд; поэтому карбоновые кислоты являются слабыми кислотами.
Как спирты различают в зависимости от числа гидроксильных групп в молекуле, так и карбоновые кислоты классифицируют по числу карбоксильных групп. Известны дикарбоновые и трикарбоновые кислоты, содержащие две и три карбоксильные группы соответственно.
Наиболее важной в биохимическом отношении функциональной группой является аминогруппа — NH2, в которой атомы водорода соединены одинарной связью с атомом азота. Различают первичные, вторичные и третичные амины, однако данные определения носят несколько иной смысл по сравнению с терминами «первичные, вторичные и третичные спирты». У вторичных аминов один из атомов водорода в аминогруппе замещен на радикал, в состав которого входят один или несколько атомов углерода, их формула R—NHR¢. Аналогичным образом третичные амины образуются замещением двух атомов водорода в аминогруппе, их формула R—NR¢ R¢¢. Органические амины — основания и поэтому способны присоединять протон, образуя положительно заряженные ионы R—NH3+. Именно эта способность и определяет важнейшую роль органических аминов в биохимии.
Следует подчеркнуть, что органические соединения сложного состава, т. е. содержащие одну или более функциональные группы, образуются не простым замещением атома водорода углеводорода на функциональную группу — синтез таких соединений гораздо более сложен.

Рис. 10. Образование полуацеталей и ацеталей
Химические реакции. Большинство химических реакций, в которые способны вступать соединения с перечисленными функциональными группами, будут обсуждаться в последующих главах применительно к конкретным вопросам биохимии, поэтому в данном разделе приводятся только общие сведения. Число реакций, используемых в биохимии, невелико, гораздо меньше, чем число реакций, известных и используемых в органической химии.
В результате окисления первичного спирта возникает альдегид, так как при вновь образуемой карбонильной группе имеется еще один атом водорода. Окисление вторичного спирта приводит к образованию кетона, имеющего две углеродные цепи, присоединенные к карбонильному углероду. Карбонильная группа может быть восстановлена до гидроксильной или окислена до карбоксильной группы. Таким образом, серия реакций окисления может быть представлена как спирт R—СН2ОН ® альдегид R—CH(О) ® карбоновая кислота R—C (O) OH, а серия реакций восстановления — обратным рядом.
Другой важной реакцией карбонильной группы является ее взаимодействие со спиртами, вернее с гидроксильной группой спиртов. Эти две функциональные группы взаимодействуют с образованием соединений, называемых полуацеталями, которые в свою очередь могут реагировать с другой гидроксильной группой, образуя полные ацетали, или просто ацетали. Схема этих важных для биохимии реакций представлена на рис. 10.
Химические реакции между карбоновыми кислотами и спиртами во многом напоминают взаимодействие между неорганическими кислотами и основаниями, и образующиеся соединения по своему строению имеют внешнее сходство с солями. В органической химии такие соединения называют сложными эфираvb и изображают как R—COO—R¢, где R —углеродная цепь карбоксильной группы, а R¢ — углеродная цепь спирта. При написании формулы сложного эфира следует иметь в виду, что оба атома кислорода присоединены к атому углерода эфирной группы. Ароматические спирты, т. е. соединения, относящиеся к фенолам, тоже могут образовывать сложные эфиры с карбоновыми кислотами; следовательно, хотя они и способны к ионизации с образованием протона, все же по своим химическим свойствам они ближе к спиртам, чем к кислотам.
Другой класс сложных эфиров образуется при взаимодействии спирта и минеральной кислоты, например фосфорной. Такие соединения играют важную роль в биохимии, так как большинство соединений фосфора в биологически важных соединениях содержатся как раз в форме фосфорных солей. Механизм образования фосфорнокислых эфиров (фосфатов) подобен образованию сложных эфиров карбоновых кислот; в состав выделяющейся воды входит гидроксильная группа спирта и атом водорода фосфорной кислоты.
Существует еще одна группа органических соединений, молекулы которых содержат кольца, составленные не только из атомов углерода и водорода, но включающие в себя атомы каких-либо других элементов, чаще всего кислорода, азота или серы. Такие гетероциклические соединения играют в биохимия гораздо большую роль, чем соединения бензольного ряда. Циклические системы такого типа имеют совершенно иные свойства, чем циклические системы, содержащие только атомы углерода. Гетероциклические соединения будут предметом подробного обсуждения в последующих главах.
Изомерия. Как ни велико разнообразие углеводородов и органических соединений, содержащих одну или несколько из упомянутых функциональных групп, круг органических молекул еще увеличивается благодаря другому их свойству — империи. Изомерными являются соединения, которые имеют одинаковую эмпирическую формулу, но отличаются по своей структуре, а потому имеют различные физические и химические свойства. Прямоцепочечные и разветвленные изомеры углеводородов уже обсуждались выше как примеры структурной изомерии. В данной главе будут рассмотрены две другие формы изомерии: геометрическая изомерия и оптическая изомерия, объединяемые общим названием стереоизомерии. Стереоизомеры имеют одинаковую эмпирическую формулу и структуру, однако у них различное расположение атомов в пространстве.

Рис. 11. Геометрическая изомерия (слева); такой тип геометрической изомерии называют цис-транс-изомерией. Оптическая изомерия (справа) для случаев, когда при атоме углерода имеются четыре различных атома или группы
Для того, чтобы понять, что такое геометрическая изомерия, необходимо мысленно провести через молекулу плоскость и определить, по какую сторону этой плоскости располагаются функциональные группы данной молекулы. Например, если два атома углерода соединены с помощью двойной связи, то можно провести плоскость через два атома углерода «посередине» двойной связи. Пусть каждый атом углерода связан с атомом водорода и карбоксильной группой. Тогда существуют две возможности расположения заместителей. Если карбоксильные группы расположены по разные стороны плоскости, то говорят, что они находятся в транс-конфигурации, и молекула такой дикарбоновой кислоты называется фумаровой кислотой. Если, наоборот, обе карбоксильные группы расположены по одну сторону плоскости, то они находятся в цис-конфигурации, и молекула такой дикарбоновой кислоты называется малеиновой кислотой. Фумаровая и малеиновая кислоты являются, таким образом, геометрическими изомерами; этот тип изомерии часто называют цис-транс-изомерией.
Для определения оптической изомерии нам придется вернуться к строению атома углерода и его ковалентным связям, образующим тетраэдр (см. стр. 20). В молекуле метана, где все четыре атома водорода равны и эквивалентны, невозможно провести различие между ними (рис. 11). Если же атом углерода связан с четырьмя различными атомами или функциональных-; группами, например, хлором, водородом, карбоксильной группой и другим атомом углерода, то говорят, что такой атом углерода замещен «асимметрически». Имеются две возможности пространственного расположения четырех групп вокруг углерода; каждое расположение является зеркальным отражением другое. Они не могут быть совмещены друг с другом, как это можно сделать с молекулами, имеющими только один или два различных атома при углероде. Если сделать пространственные модели такого трехзамещенного метана, то как бы мы ни вращали эти модели, совместить одинаковые заместители при наложении не представляется возможным.
Эти две модели и представляют собой два оптических изомера молекулы, их называют энантиомерами. Изомеры этого типа имеют одинаковые физические и химические свойства — одинаковые температуры плавления и кипения, растворимость и пр. Эти две формы отличаются друг от друга только отношением к поляризованному свету (Не только этим, но и способностью кристаллизоваться в асимметрических (энантноморфных) формах. — Прим. ред.). В то время как колебания обычного света имеют различные направления, для поляризованного света они находятся в одной плоскости, называемой плоскостью поляризации. Таким свет становится при прохождении через специальный фильтр, пропускающий колебания только в одной плоскости и отрезающий все другие. Если поляризованный свет пропустить через раствор одного из энантиомеров, плоскость его поляризации поворачивается влево; раствор другого энантиомера будет поворачивать плоскость поляризации вправо. Эти два энантиомера называют соответственно (—) формой и (+) формой. Так как степень вращения (угол вращения плоскости поляризации) зависит от концентрации раствора энантиомера и от структуры молекулы, энантиомеры различных соединений будут поворачивать плоскость поляризации на разные углы. Оптические изомеры будут обсуждаться более полно в основных классах биохимических соединений.
В следующих главах станет ясно, как обсуждаемые выше вопросы могут быть использованы для понимания структуры молекул живых организмов, таких, как сахара, жирные кислоты, аминокислоты, и как эти малые «строительные блоки» соединяются друг с другом, образуя гигантские молекулы. Понятие «гигантская молекула» весьма относительное; считают, что это молекула, молекулярная масса которой превышает десять тысяч. Однако ниже мы увидим, что молекулы даже такого размера могут показаться малыми для биохимика, который подчас имеет дело с макромолекулами, имеющими молекулярную массу в несколько миллионов. Именно их чрезвычайно сложная структура при колоссальных размерах и делает биохимию необычайно интересным предметом исследования.
Огл. Углеводы
Углеводы составляют абсолютное большинство органических соединений на земле. Углеводы, с которыми мы сталкиваемся в повседневной жизни, например в виде сахара или крахмала, — соединения преимущественно растительного происхождения. Они представляют собой основной компонент пищи для большинства животных, которые либо сами питаются растениями, либо питаются растительноядными животными. Являясь основным компонентом нашей ежедневной пищи, углеводы поставляют большую часть энергии, необходимой для живого организма. Кроме того, они играют важную роль в структуре живых систем.
Углеводы были открыты до того, как стали понятны молекулярные аспекты химии. Вначале было найдено, что они содержат только углерод, водород и кислород (причем два последних в том же соотношении, что и в воде), т. е. являются как бы соединениями угля с водой, поэтому им приписали общую формулу Cx(H2O)y, где х и у — целые числа. Позже стало ясно, что такое определение не является точным, так как были выделены другие соединения, которые по химическим и физическим свойствам хотя и подходят к классу углеводов, однако не содержат водорода и кислорода в соотношении 2:1. Примером таких соединений может служить дезоксирибоза, имеющая общую формулу C6H10O4. Были также обнаружены соединения, содержание водорода и кислорода в которых не соответствовало отношению 2:1, но которые тем не менее имели свойства углеводов. С другой стороны, молочная кислота имеет общую формулу C2H6O3, однако не принадлежит к классу углеводов. Позже были открыты углеводы, которые кроме углерода, водорода и кислорода содержали еще азот и серу.
В настоящее время считают, что принадлежность углеводов и некоторых родственных им соединений к данному классу следует определять по общей структуре; термин «углеводы» хотя и продолжает широко применяться, но он не точен.
Моносахариды. Моносахаридами называют простые углеводы или простые сахара, представляющие собой молекулы, которые нельзя расщепить на более мелкие углеводные звенья при относительно мягких химических условиях. Более сложные углеводы, которые будут обсуждаться ниже, состоят из цепей моносахаридов, соединенных концами. Если число моносахаридов в цепи невелико, такой углевод называется олигосахаридом, если их много, то такой углевод называется полисахаридом.
С химической точки зрения, моносахариды, содержащие альдегидную группу, являются полиоксиальдегидами и называются альдозами, а моносахариды, содержащие кетонную группу, являются полиоксикетонами и называются кетозами. Как правило, их молекулы состоят из неразветвленных углеродных цепей, содержащих карбонильную или альдегидную группу при одном из атомов углерода и гидроксильные группы — при остальных атомах углерода. По числу атомов углерода в скелете моносахариды подразделяются на триозы — простейшие моносахариды. содержащие три атома углерода, тетрозы — четыре, пентозы — пять, гексозы — шесть атомов углерода. Известны и высшие моносахариды с семью, восемью, девятью и даже большим числом атомов углерода, но они не представляют особого интереса для биохимии. К настоящему времени известно около семидесяти моносахаридов, двадцать из которых встречаются в природе, а остальные получены синтетически; но только некоторые из распространенных в природе сахаров представляют для нас интерес. Всем им присущи сладкий вкус, хорошая растворимость в воде, плохая растворимость (или даже нерастворимость) в органических растворителях, например в спирте или эфире.

Рис. 12. Глицериновый альдегид (альдегидоспирт); диоксиацетон (кетоспирт)
Изомерные формы. Простейшие моносахариды с тремя углеродными атомами, такие, как глицериновый альдегид (альдоза и диоксиацетон (кетоза), представлены на рис. 12. Именно из этих триоз могут быть получены все длинноцепочечные альдозы и кетозы (по крайней мере, на бумаге — на самом деле биохимики и органики используют более сложные пути получения углеводов). Высшие альдозы и кетозы можно получить из триоз путем последовательного внедрения группы НСОН между карбонильным атомом углерода и следующим по цепи атомом. Следует подчеркнуть, что второй атом углерода в глицериновом альдегиде является асимметрическим, у него четыре различных заместителя, и, следовательно, два его зеркальных изображения не могут быть совмещены друг с другом. Поэтому глицериновый альдегид существует в виде двух оптических изомеров. Обычно моносахариды принято изображать так, что альдегидная группа находится у первого атома углерода, а группа СН2ОН — на конце цени. Тогда оптические изомеры глицеринового альдегида отличаются положением гидроксильной группы при среднем атоме углерода. Если группа ОН расположена справа от цепи, то молекулу относят к правовращающей конфигурации D, если слева — к левовращающей конфигурации L.
D-глицериновый альдегид лежит в основе классификации всех биохимически важных соединений, которые существуют в виде оптических изомеров, и не только моносахаридов, но и других соединений, обсуждаемых в последующих главах. Так, если изобразить пентозу с альдегидной группой при первом атоме углерода, то расположение гидроксильной группы у самого нижнего асимметрического атома углерода определяет, к какому типу (D или L) изомеров принадлежит эта пентоза: если гидроксильная группа расположена справа, то это D-пентоза, а если слева, то L-пентоза. Здесь следует подчеркнуть, что обозначения D и L вовсе не служат указанием на направление вращения плоскости поляризации. Совершенно случайно, что D-глицериновый альдегид вращает плоскость поляризации света вправо, а его L-изомер — влево. Многие соединения, отнесенные к D-ряду, являются левовращающими, а многие представители L-ряда — правовращающими. Чтобы указать и принадлежность моносахарида к D- или L-ряду, и направление вращения, после буквы D или L ставят перед названием сахара в скобках знак (+) или (—), обозначающий правое или левое вращение. Так, D-глицерицовый альдегид следует изображать как D(+)-глицериновый альдегид, а его L-форму как L(—)-глицериновый альдегид. Могут встретиться такие обозначения, как D(—)-пентоза или L(+)-гексоза. Как правило, живые организмы могут синтезировать и использовать члены лишь одного ряда соединений. Среди моносахаридов в природе найдены только соединения с D-конфигурацией, вращающие плоскость поляризации света как вправо, так и влево.
Всякий раз, когда углеродная цепь моносахарида удлиняется посредством включения группы НСОН между карбонидом и соседним углеродным атомом, появляется новый асимметрический атом углерода, поэтому моносахариды с более длинной углеродной цепью имеют большее число изомерных форм. Так, у тетроз, образуемых от глицеринового альдегида, имеются два асимметрических атома углерода и для них возможны четыре изомера, две D- и две L-формы; причем каждая пара D- и L-форм имеет различное расположение гидроксильных групп и атомов водорода при втором атоме углерода. Для пентоз, производных от глицеринового альдегида, возможно образование восьми изомеров, а для гексоз известно существование уже шестнадцати изомерных форм. Число возможных изомеров у моносахарпда равно 2n где п — число асимметрических атомов углерода. Например, для гексоз с четырьмя центрами асимметрии число изомеров равно 24, т. е. шестнадцати.

Рис. 13. Три наиболее распространенные гексозы
Если изображать структуру моносахаридов, согласно принятым правилам (см. стр. 36), то различные изомеры будут отличаться друг от друга положением их гидроксильных групп про всех атомах углерода, кроме последнего, который определяет принадлежность моносахарида к D- или L-ряду. Так, для гексоз имеются восемь пар соединений с различной конфигурацией их углеродных атомов, два из этих изомеров представлены на рис. 13. D- и L-изомеры каждой пары соединений имеют одинаковые химические и физические свойства и отличаются только своим отношением к поляризованному свету. Однако различия в структуре таких изомеров достаточны, чтобы у этих моносахаридов были разные температуры плавления и кипения, растворимость и т. д. Например, манноза и галактоза по своим химическим и физическим свойствам — различные моносахариды, но поскольку они не являются энантиомерами, их называют диастереомерами. D-манноза — энантиомер по отношению к L-маннозе и диастереомер по отношению к D-галактозе и другим гексозам — производным глицеринового альдегида.
Диоксиацетон (см. рис. 12) не имеет асимметрического углеродного атома. Если группа НСОН вводится в молекулу, то образуется тетроза и появляется возможность оптической изомерии; однако только с появлением пятого атома углерода могут образовываться диастереомеры. Для кетопентоз возможно наличие четырех оптических изомеров (две D- и две L-формы), а для кетогексоз — уже восемь. D- и L-формы кетоз также (на бумаге) отличаются расположением гидроксильных групп при асимметрическом атоме углерода, наиболее удаленном от карбонильной группы. Кетозы почти не представляют интереса для биохимии, за исключением кетогексозы, называемой фруктозой.
Циклические структуры. До сих пор для описания моносахаридов использовались формулы с прямой цепью. Такие формулы хотя и удобны для изображения изомерных форм и демонстрации общих свойств молекулы, но не отражают всех свойств этих соединений. Например, моносахариды изображаются как альдегиды, однако они не обнаруживают характерных химических свойств простых альдегидов. Далее, известны две кристаллические формы D(+)-глюкозы; используя формулы с прямой цепью, невозможно объяснить причину различия этих форм, которые ведут себя неодинаково по отношению к поляризованному свету. В свежеприготовленном растворе моносахарида в воде определенная часть молекул переходит из одной формы в другую до достижения в растворе равновесия обеих форм (угол вращения смеси 52,5°). Таким образом, угол вращения плоскости поляризации зависит от присутствия обеих форм в смеси. Это изменение угла вращения во времени назвали мультиротацией (или мутаротацией — перев.) именно оно указывает на существование двух форм D(+)-глюкозы.

Рис. 14. Циклические структуры для глюкозы
В природе пентозы и гексозы находятся главным образом в виде циклических структур, и только небольшая часть молекул имеет открытую цепь. Образование циклических структур становится легко понятным, если вспомнить, что четыре ковалентные связи углерода образуют тетраэдр, поэтому углеродная цепь не представляет собой прямую, а существенно изогнута. Два конца этой цепи вовсе не удалены друг от друга, а довольно близко расположены в пространстве. В глюкозе, например, гидроксильная группа при пятом атоме углерода находится очень близко к карбонильной группе при первом атоме углерода. Такое расположение способствует взаимодействию между карбоксильной и гидроксильной группами с образованием внутреннего полуацеталя, и, следовательно, замыканию цикла. Такая реакция характерна для всех моносахаридов, и следствием ее является образование циклических структур.
В зависимости от того, гидроксильная группа какого из углеродных атомов принимает участие в образовании внутреннего полуацеталя, могут образовываться пятичленные циклы (из четырех атомов углерода и одного атома кислорода) или шести-членные циклы (из пяти атомов углерода и одного атома кислорода). Эти структуры называются соответственно фуранозными и пиранозными циклами. Для моносахаридов ряда пентоз обычно характерен фуранозный цикл, в то время как большинство гексоз находится в шестичленной пиранозной форме. Образования семичленных колец, которые могли бы получиться при взаимодействии карбонила и гидроксильной группы при шестом атоме углерода гексозы, не наблюдается из-за значительного напряжения связей в таком цикле.
Способ изображения циклических структур моносахаридов был предложен Хеуорсом. Замыкание цикла и способ изображения циклических структур для глюкозы представлены на рис. 14. С образованием цикла в молекуле моносахарида появляется новый асимметрический центр. На одной из циклических структур (см. рис. 14) гидроксильная группа при первом углеродном атоме расположена выше, а на другой — ниже плоскости кольца; эти две структуры соответствуют двум кристаллическим формам D(+)-глюкозы, упомянутым выше. Молекула глюкозы с гидроксильной группой при первом углеродном атоме, расположенной ниже плоскости кольца, называется a -формой, а молекула с гидроксильной группой выше плоскости — b -формой. Полное название этих молекул — a -D( + )-глюкоза и b -D( + )-глюкоза.
Наиболее распространенные сахара. Из наиболее распространенных в природе моносахаридов — пентоз следует упомянуть рибозу и дезоксирибозу, которые являются составными частями соединений, называемых нуклеотидами и нуклеиновыми кислотами (см. стр. 87). В этих соединениях сахара находятся в циклической фуранозной форме, и дезоксирибоза отличается от рибозы только отсутствием гидроксильной группы при втором углеродном атоме кольца. Две другие рибозы природного происхождения — арабиноза и ксилоза распространены не в виде свободных сахаров, а входят в состав растительных полисахаридов.
В природе большое значение имеют четыре гексозы (одна кетогексоза и три альдогексозы). Самая важная и самая распространенная из моносахаридов — глюкоза (ее называют также виноградным сахаром или декстрозой). Она содержится в свободном виде в сладких фруктах, в виде основного звена входит в состав многих полисахаридов, используемых живыми организмами в качестве структурных компонентов или энергетического резерва. D(+)-манноза отличается от глюкозы только положением атома водорода и гидроксильной группы при втором атоме углерода пиранозного кольца; она может встречаться я в свободном виде, но чаще вместе с другими моносахаридами образует длинные полисахаридные цепи. D(+)-галактоза, третья альдогексоза, обычно не встречается в свободном виде, а в комбинации с глюкозой входит в состав полисахаридов. Галактоза отличается от глюкозы только положением водорода и гидроксильной группы у четвертого углеродного атома.
Наиболее распространенной в природе кетогексозой является фруктоза. Она вращает плоскость поляризации света влево, но относится к D-ряду кетогексоз и имеет одинаковую конфигурацию с D-глюкозой. В свободной форме фруктоза встречается в меде, а также в некоторых фруктах. Обычно она существует в пиранозной форме, в виде внутреннего полуацеталя из кето-группы при втором атоме углерода и гидроксильной группы при шестом. Однако в олигосахаридах и полисахаридах фруктоза существует преимущественно (в комбинации с глюкозой) в фуранозной форме.
Химические превращения моносахаридов. Химические реакции, в которые вступают моносахариды, определяются главным образом наличием у них гидроксильных групп и лишь небольшое число реакций — карбонильной группой. Это объясняется тем, что в молекулах моносахаридов альдегидные и кетонные группы обычно существуют в полуацетальной форме. Восстановительные свойства моносахаридов обусловлены той небольшой долей молекул со свободными карбонильными группами, которая присутствует в моносахаридах и используются для анализа сахаров. Например, если раствор какой-либо серебряной соли смешать с раствором сахара, то ион серебра Ag+ восстановится до атомарного Ag и осядет на стенках сосуда. Этот налет серебра сообщает стенкам сосуда зеркальный блеск, поэтому реакция называется реакцией «серебряного зеркала». Растворы, содержащие ионы Cu2+, тоже восстанавливаются растворами сахаров до ионов Cu, нерастворимых в щелочных растворах, о чем свидетельствует образование кирпично-красного осадка (эта реакция лежит в основе так называемой реакции Фединга).
Реакции с участием гидроксильных групп приводят к образованию важных производных моносахаридов. Так, окисление конечной группы — СН2ОН в карбоксильную группу (без затрагивания альдегидной группы) дает соединения, называемые уроновыми кислотами. Глюкуроновая кислота — продукт окисления глюкозы — очень легко соединяется с другими моносахаридами с образованием олигосахаридов и полисахаридов. Многие продукты распада выводятся с мочой из организма млекопитающих только после соединения с глюкуроновой кислотой.

Рис. 15. Наиболее распространенные моносахариды
Гидроксильные группы в моносахаридах вступают в те же химические превращения, что и простые органические спирты; среди них наибольшее значение имеют реакции, приводящие к образованию сложных эфиров, в частности фосфорнокислых эфиров. Например, этерификация фосфорной кислотой гидроксильной группы при первом или шестом атоме углерода в глюкозе дает соответственно глюкозо-1-фосфат или глюкозо-6-фосфат. Эти оба соединения играют важнейшую роль в метаболизме углеводов: этерификация фосфорной кислотой «активирует» сахара, после чего они могут принимать участие в разнообразных реакциях. Приведенные выше фосфаты глюкозы — производные одного и того же сахара, однако они имеют разные химические свойства и играют различную роль в биохимических процессах.
Пентозы — рибоза и дезоксирибоза — всегда присутствуют в нуклеотидах и нуклеиновых кислотах (см. стр. 93) в виде фосфорнокислых эфиров. Рибоза образует сложные эфиры в результате взаимодействия фосфорной кислоты с гидроксильной группой при втором, третьем и пятом атомах углерода. Дезоксирибоза не имеет гидроксильной группы при втором атоме и, следовательно, может образовывать только дезоксирибозо-3-фосфат или дезоксирибозо-5-фосфат.
Замещение в моносахариде одной из гидроксильных групп на аминогруппу приводит к образованию другого ряда производных сахаров, называемых аминосахарами. Один из широко распространенных в природе аминосахаров — L-глюкозамин отличается своим строением от D-глюкозы только наличием аминогруппы при втором углеродном атоме пиранозного кольца. Он входит в состав многих полисахаридов. Другое важное производное — галактозамин, в котором гидроксильная группа пря втором углеродном атоме галактозы замещена на аминогруппу, входит в состав основного полисахарида хрящей. Некоторые из производных моносахаридов представлены на рис. 15.
Олигосахариды. В результате типичной химической реакция полуацеталей — их взаимодействия с гидроксильной группой спиртов — образуются полные ацетали, или просто ацетали. Известны также полуацетали циклических структур моносахаридов.
Ацетали моносахаридов называют гликозидами, а связь, с помощью которой моносахариды могут соединяться друг с другом. — гликозидной.

Рис. 16. Типы гликозидных связей в дисахаридах
В зависимости от числа моносахаридных остатков, соединенных гликозидными связями, высшие углеводы относят к олигосахаридам или полисахаридам. Олигосахариды (от греческого слова «олигос», что означает немного) составлены из двух — восьми моносахаридных остатков. В свою очередь они подразделяются на дисахариды, образованные из двух сахаров, трисахариды — из трех сахаров и т. д. Углеводы с более чем восемью моносахаридными остатками называют полисахаридами; общее число таких остатков может достигать многих сотен и даже тысяч. Во всех случаях, независимо от того два или две тысячи моносахаридов соединены друг с другом, они присутствуют в циклической форме.
Гликозидная связь образуется между первым атомом углерода, т.е. карбонильным атомом углерода в альдозах (или вторым карбонильным атомом углерода в кетозах), одного моносахарида и гидроксильной группой при втором, третьем, четвертом или шестом атоме углерода другого моносахарида. В отличие от a - и b -форм глюкозы и других моносахаридов, a - и b -гликозиды не могут переходить друг в друга.
Наиболее важными в биохимическом отношении олигосахаридами являются дисахариды; это, как и моносахариды, — кристаллические вещества, растворимые в воде, сладкие на вкус. Если одна из моносахаридных составляющих имеет свободную гидроксильную группу при первом атоме углерода, то дисахарид будет проявлять свойства восстановителя, давая реакцию на серебряное зеркало и положительную реакцию Фелинга. Простейший дисахарид этого типа — соединение, выделенное из солода, поэтому оно называется солодовым сахаром, или мальтозой. Можно считать, что все дисахариды с восстановительными свойствами — мальтозного типа. Наличием свободной гидроксильной группы при первом атоме углерода объясняется также мультиротация дисахаридов (подобно двум кристаллическим формам D-глюкозы (см. стр. 38).
Молекула мальтозы состоит из двух остатков глюкозы, соединенных a -1-4-гликозидной связью. Это означает, что гидроксил при первом атоме углерода одной молекулы глюкозы находится в a -конфигурации и что он связан с другой молекулой глюкозы через гидроксильную группу при четвертом атоме углерода. Две молекулы глюкозы, соединенные a -1-6-глюкозидной связью, образуют дисахарид, называемый изомальтозой. Это соединение не имеет широкого распространения в свободном состоянии, хотя и является составной частью некоторых полисахаридов.
Большой интерес представляют два других дисахарида с восстановительными свойствами. Один из них — целлобиоза — состоит из двух молекул глюкозы, соединенных b -1-4-гликозидной связью. Это значит, что полуацетальная гидроксильная группа при первом атоме углерода находится в b -конфигурации и соединена с другим остатком глюкоаы с помощью гидроксильной группы при четвертом атоме углерода, как в мальтозе. Другой дисахарид — лактоза — тоже образуется из двух моносахаридных остатков, соединенных b -1-4-связью, но в этом случае одна молекула глюкозы соединена с молекулой галактозы (полуацетальный гидроксил галактозы образует связь с гидроксильной группой при четвертом атоме углерода глюкозы) (рис. 16). Лактоза содержится в больших количествах в молоке млекопитающих: у человека — примерно 6%, у коровы —5%.

Рис. 17. Принцип использования центрифугирования для определения молекулярной массы полисахаридов
Гликозидная связь может образоваться и при взаимодействии гидроксильных групп при карбонильном атоме углерода двух моносахаридов. Очень важный дисахарид именно с такой связью, называемый сахарозой, чрезвычайно широко распространен в растительном мире. Однако в пищу употребляется только сахароза из сахарной свеклы и сахарного тростника.
В сахарозе полуацетальные группы обоих моносахаридных остатков вовлечены в гликозидную связь, поэтому такой дисахарид не обладает восстанавливающими свойствами и не подвергается мультиротации. Сахароза состоит из молекул глюкозы и фруктозы; интересно, что фруктозная составляющая присутствует в ней в виде пятичленного фуранозного кольца, а не в пиранозной форме, как в свободной форме фруктозы. Сахароза вращает плоскость поляризации света вправо; однако если этот дисахарид разделить на составляющие, то их смесь будет лево-вращающей (что объясняется присутствием фруктозы). Расщепление сахарозы на составляющие части называется инверсией; образующаяся смесь — инвертный сахар обычно вместе с самой сахарозой входит в состав пчелиного меда.
Полисахариды. У олигосахаридов типа мальтозы есть свободная гидроксильная группа при карбонильном атоме углерода одного из моносахаридных остатков. К ней могут присоединяться другие моносахариды. Таким образом образуются цепи из многих остатков, называемые полисахаридами. Полисахариды очень широко распространены в природе, они играют важную роль в образовании структуры живого организма или служат для него запасными питательными веществами. В обоих случаях роль данного полисахарида определяется тем, из остатков каких моносахаридов состоит его макромолекула и каким именно способом эти остатки соединены друг с другом.
Поскольку полисахариды могут состоять из многих тысяч моносахаридов, их молекулярные массы должны быть чрезвычайно высокими. Иногда для определенного полисахарида нельзя указать точную молекулярную массу, т. е. точно не известно, из какого числа мономерных звеньев состоит его цепь. Понятно, что если цепь полисахарида состоит из нескольких тысяч звеньев, то добавление 10, 50 или даже 100 звеньев не повлияет сильно на химические и физические свойства его макромолекулы в целом, и данный полисахарид может существовать в виде смеси молекул различной длины.
Для определения молекулярной массы полисахаридов чаще всего используется метод центрифугирования (рис. 17).
Существует много способов связывания мономерных звеньев, и поэтому число различных полисахаридов просто астрономическое. Они могут быть составлены из самых разнообразных мономерных звеньев, расположенных в самой различной последовательности и соединенных друг с другом через гидроксильные группы при втором, третьем, четвертом или шестом атомах углерода; с помощью гидроксильной группы при карбонильном атоме углерода сахара, уже образовавшего цепочку, и гидроксильной группы сахара, являющейся частью другой цепи.
Чтобы узнать, какие именно моносахаридные звенья присутствуют в цепи, ее нужно расщепить и проанализировать полученную смесь моносахаридов. При образовании гликозидной связи между двумя моносахаридами, выделялась молекула воды, следовательно, эту связь можно разорвать с помощью реакции гидролиза (присоединения воды). Реакция протекает с большим трудом, поэтому обычно углеводы обрабатывают сильной, например соляной, кислотой. Если полисахарид составлен только из одного типа моносахаридных остатков, анализ его состава сильно упрощается (Полисахариды такого типа называются томогликанами). Полисахариды другой группы, называемые гетерогликанами, состоят из остатков двух или более различных моносахаридов. Анализировать такие полисахариды значительно труднее: необходимо установить не только характер составляющих, но также, в каком порядке и с помощью каких связей эти остатки соединены друг с другом. Для этих целей используют особые вещества, называемые ферментами, которые вызывают гидролиз и к тому же разрывают полисахаридные цепи только в определенных местах (например, только гликозидную связь между глюкоэным и галактозным остатком). Как только цепь разорвана на более мелкие фрагменты, анализ полисахарида значительно упрощается. Если молекула полисахарида состоит из нескольких типов мономерных звеньев моносахаридов, соединенных различными типами связей, приходится применять набор ферментов, каждый из которых разорвет цепь в определенном месте, т. е. сможет подействовать только на определенный тип гликозидной связи. Таким способом из нескольких образцов одного и того же полисахарида путем гидролиза можно получить набор более мелких фрагментов цепи, и если проанализировать каждый из таких фрагментов, то можно составить представление о структуре всей цепи в целом. Большинство полисахарпдов состоит из мономерных звеньев самого распространенного моносахарида — глюкозы, иногда в сочетании с фруктозой, галактозой и другими гексозами.
Значительный интерес представляют только три или четыре полисахарида, рассматриваемые ниже.
Целлюлоза. Это очень важный полисахарид, основной компонент растений, содержащийся главным образом в стенках растительных клеток и составляющий большую часть вещества: хлопок и лен, например, содержат от 90 до 99% чистой целлюлозы, древесные породы — до 45%. Установлено, что в природе целлюлозы больше, чем какого-либо другого органического соединения.
При полном гидролизе целлюлозы образуется только D-глюкоза, т.е. целлюлоза является гомогликоном. Частичный гидролиз дает дисахарид целлобиозу, следовательно, целлюлоза представляет собой цепь из повторяющихся остатков этого дисахарида. Все моносахаридные звенья целлюлозной цепи соединены друг с другом b -1-4-гликозидной связью, так же как и сахара в целлобиозе. Молекулярная масса целлюлозы, по-видимому, сильно варьирует: по данным одних работ, она достигает 50 тысяч, по данным других, — двух миллионов. Макромолекула целлюлозы очень велика, она состоит из многих тысяч звеньев D-глюкозы, соединенных в длинные прямые цепи.
Именно полому целлюлоза является основным структурным компонентом растительных тканей. Длинные прямые цепи макромолекул собраны в пучки, или волокна, причем все молекулы расположены однонаправлено. Пучки макромолекул образуют кристаллоподобные нити, прочность которых больше, чем прочность проволоки высококачественной стали такого же диаметра. Пучки в нитях называют мицеллами. Если однотипная ориентация макромолекул целлюлозы нарушена, то волокна целлюлозы теряют свою высокую прочность. Целлюлоза с неориентированными макромолекулами используется, например, для производства материала, называемого целлофаном.
Крахмал и гликоген. Крахмал — основной полисахарид, который служит запасным питательным веществом растений. Растительные клубни, например картофель, почти полностью состоят из крахмала, а фрукты и зерна включают до 70% крахмала. Подобно целлюлозе, крахмал состоит из остатков глюкозы, потому, когда растению нужны питательные вещества, ему необходимо только расщепить некоторое количество крахмала и использовать образующуюся глюкозу.
На этом сходство крахмала с целлюлозой кончается. Крахмал присутствует в растениях в виде гранул, поэтому он не имеет упорядоченной кристаллической структуры, которая так важна для структурных полисахаридов растений. Крахмал состоит из двух фракций, отличающихся по типу строения, входящих в их состав полисахаридов, — амилозы и амилопектина; последний составляет обычно 70—80% крахмала (рис. 18).
В результате частичного гидролиза амилозы образуются преимущественно дисахариды типа мальтозы, т. е. можно сделать вывод, что остатки глюкозы в амилозе соединены a -1-4-глюкозидными связями. Цепи этого компонента крахмала — прямые и неразветвленные, содержащие обычно около трехсот мономерных единиц глюкозы. Характерной пробой на крахмал является так называемая йодная реакция — появление синего окрашивания при действии йода на крахмал (на амилозу крахмала).
Структура амилопектина существенно отличается от структуры амилозы. При гидролизе он дает смесь дисахаридов — мальтозу и изомальтозу; следовательно, амилопектин состоит из остатков глюкозы, соединенных a -1-4-связью и a -1-6-связью. В отличие от амилозы, амилопектин — высокоразветвленная молекула и значительно больше по размеру (молекулярная масса достигает 500 тысяч).
В организме животных (главным образом в мышцах и печени) содержится другой «резервный» полисахарид — гликоген. Он состоит только из остатков D-глюкозы, поэтому организм легко использует гликоген для своих обменных реакций. Молекулярная масса гликогена варьирует от 300 тысяч до 10 миллионов. Гликоген еще более разветвлен, чем амилопектин: цепь между разветвлениями включает 10—20 звеньев. В отличие от большинства полисахаридов, гликоген растворим в воде.

Рис. 18. Наиболее распространенные полисахариды
Прочие полисахариды. Целлюлоза, крахмал и гликоген — наиболее важные полисахариды, встречающиеся в природе. Однако следует упомянуть еще несколько других полисахаридов. Например, полисахарид инулин, состоящий главным образом из пятичленных колец фруктозы, в виде запасного питательного вещества содержится в луковицах многих растений и определяет вкус аспарагуса и артишока. Назовем также пектины — полисахариды, состоящие из остатков галактозы, арабинозы и галактуроновой кислоты, соединенных a -1-4-связью. Пектины содержатся во многих фруктах и используются, например, для приготовления джема или желе.
Среди полисахаридов, встречающихся в организме животных, отметим хитин — темный твердый блестящий материал, который образует внешние покровы многих насекомых, а также ракообразных. В состав хитина входят уроновые кислоты и такие производные моносахаридов, как N-ацетил-D-глюкозамин. Другой полисахарид — гиалуроновую кислоту с молекулярной массой до 5 миллионов, содержащую в своем составе N-ацетил-В-глюкозамин и D-глюкуроновую кислоту, можно обнаружить, например, в стекловидном теле глаза. В соединительных тканях животных встречаются также полисахарид хондроитин-сульфат, в котором группа СН2ОН в положении шесть аминосахара этерифицирована серной кислотой.
Полисахариды могут входить в состав многих соединений, однако в природе они чаще всего встречаются в растениях. Одна из основных функций этих соединений — структурная, они выполняют опорную роль, их физическая и химическая приспособительная изменчивость ограничена. В растительном мире неподвижность структуры оправдана. Однако в мире животных требуется гибкость структуры (например, насекомые, имеющие твердые покровы, ограничены в росте). Поэтому значительная часть структурных элементов в организме животных состоит из других биохимических соединений: липидов и белков, которые позволяют им достигнуть большей подвижности и лучше приспособиться к условиям существования. Следующие главы посвящены описанию строения и функций именно этих классов соединений.
Огл. Липиды
В повседневной жизни, встречая слово жир, мы тотчас представляем себе жиры, которые обычно употребляем — это сливочное масло, маргарин, сало, иногда и другие пищевые жиры. Это только немногие примеры того класса соединений, который биохимики называют липидами. Все липиды гостоят главным образом из элементов углерода, водорода и кислорода, почти все они нерастворимы в воде, но хорошо растворяются в органических растворителях типа эфира, хлороформа и четыреххлористого углерода. О других общих свойствах говорить трудно, потому что липиды представлены различными группами соединений, и даже биохимики считают нелегким дедом классифицировать их и стандартизовать их названия.
Наиболее удобный путь для изучения липидов — разделение их на два больших класса: простые и сложные липиды. Простые липиды охватывают масла, жиры и воска, они являются сложными эфирами спирта, называемого глицерином, и длинноцепочечных карбоновых кислот. Сложные липиды содержат в своем составе не только карбоновые кислоты и спирты, которые могут отличаться от глицерина, но и другие, например, содержащие фосфор группы, а также сложные органические вещества типа углеводов и белков. Класс сложных липидов включает фосфолипиды, гликолипиды и липопротеины соответственно. Вместе с липидами обычно изучают соединения, называемые стероидами, хотя они отличаются от липидов по структуре, свойствам и функциям в организме. Некоторые примеры этого типа соединений будут описаны в конце данной главы.
Простые липиды — триглицериды. (Международная номенклатурная комиссия недавно рекомендовала отказаться от этого названия как от химически неточного и заменить его названием триацилглицерины, а глицериды — словом ацилглицерины. — Прим. ред.) Спирт, входящий в состав жиров и масел, — глицерин — трехатомный и поэтому способен образовывать сложные эфиры с одной, двумя или тремя молекулами карбоновой кислоты. Получающиеся при этом соединения называют глицеридами, а именно моноглицеридами, диглицеридами и триглицеридами. Жиры и масла в основном состоят из триглицеридов, поэтому нас будут интересовать только триглицериды. Три молекулы карбоновой кислоты, которые образуют сложные эфиры с глицерином в конкретном жире, могут быть одного типа или разными, или две молекулы одинаковые, а одна — другой кислоты. Их распределение в молекуле глицерина, по-видимому, случайно. В образце конкретного жира могут быть молекулы, в которых определенные карбоновые кислоты занимают либо крайнее, либо среднее положение, что, вероятно, мало влияет на молекулу в целом. У таких карбоновых кислот очень длинная углеродная цепь. Это обычно монокарбоновые кислоты, у которых карбоксильная группа находится в конце углеродной цепи. Чаще их называют жирными кислотами, потому что они были открыты как составная часть жиров.
Хотя число жирных кислот, встречающихся в природе, очень велико, в состав липидов входят лишь некоторые из них. Наиболее распространены три жирные кислоты, на долю которых приходится примерно 90% всех жирных кислот, образующих триглицериды жиров и масел; они имеют углеродную цепь длиною 16 или 18 атомов. Для кислотных остатков глицеридов жирных кислот характерно наличие четного числа атомов углерода, что, по-видимому, является следствием условий их синтеза в живых организмах, где они образуются путем прибавления двууглеродных звеньев к растущей углеродной цепи.
Жирные кислоты в зависимости от способа соединения атомов в углеводородной части молекулы липида можно подразделить на две основные группы — насыщенные и ненасыщенные кислоты. Это определяет также и различие в свойствах между жирами и маслами: жиры составлены только из насыщенных жирных кислот, в то время как масла содержат один или более остатков ненасыщенной кислоты. Глицериды ненасыщенных жирных кислот имеют более низкие температуры плавления по сравнению с глицеридами насыщенных кислот, и чем больше остатков жирных кислот является ненасыщенными, тем больше двойных связей в углеводородных цепях этих кислот и тем ниже их температуры плавления.
Вот интересный пример взаимосвязи структуры остатков жирных кислот и температур их плавления. Морские анемоны или актинии, Metridium dianthus содержат в своих тканях большое количество жиров. У животных этого вида из теплых экваториальных морей жиры, состоящие из триглнцеридов насыщенных жирных кислот, при температуре воды обитания находятся в жидком состоянии. У родственных видов этих животных из холодных вод жиры являются триглицеридамя более ненасыщенных жирных кислот, которые имеют более низкую температуру плавления и поэтому находятся в жидком состоянии даже при низких температурах. Если экваториальные виды поместить в холодные воды, содержащийся в них жир затвердееет и анемоны полностью теряют подвижность.
Общая формула насыщенных жирных кислот R—СООН, где R — углеводородная часть молекулы с формулой СН3(СН2)n —. Число СН2-звеньев может достигать 86, т. е. молекула жирной кислоты будет содержать 88 атомов углерода, как, например, в миколевой кислоте. Однако чаще в состав триглицеридов входит пальмитиновая кислота с 16 и стеариновая кислота с 18 атомами углерода. Кислоты с более короткими и более длинными углеводородными цепями присутствуют в большинстве жиров только в незначительных количествах. Как правило, в составе данного жира преобладает одна из кислот: например, в говяжьем жире присутствует только стеариновая кислота.
Большинство ненасыщенных жирных кислот, содержащихся в жирах и маслах, имеет только одну двойную связь в углеводородной цепи и поэтому называется мононенасыщенными кислотами, их общая формула R—СН = СН— (СН2)7-СООН. Если считать углерод карбоксильной группы первым, то двойная связь находится между девятым и десятым атомами углерода; значение положения двойной связи неясно (рис. 19).

Рис. 19. Составляющие простых липидов
У ненасыщенных, как и насыщенных жирных кислот, преобладают углеводородные цепи с 16 и 18 атомами углерода. Наиболее распространенными являются пальмитоолеиновая кислота с 16 и олеиновая кислота с 18 атомами углерода. Некоторые из масел содержат преимущественно одну кислоту; оливковое масло, например, является в основном триглицеридом олеиновой кислоты. В структуре молекулы встречаются жирные кислоты с более чем одной двойной связью, их называют полиненасыщенными кислотами. Как правило, первая двойная связь также находится между девятым и десятым атомами цепи, а другие двойные связи — в удаленной от карбоксильной группы части молекулы.
Наличие двойной связи в углеводородной цепи создает возможность цис-транс-изомерии жирных кислот. Атомы водорода у углеродов при двойной связи могут находиться по одну сторону плоскости, проведенной через двойную связь (цис-конфигурация), или по разные стороны от этой плоскости (транс-конфигурация). Среди большинства пар стереоизомеров в природе распространена только одна форма, в данном случае — цис-форма ненасыщенных жирных кислот.
Превращение ненасыщенных триглицеридов в полностью насыщенные аналоги — несложный процесс, играющий важную роль в пищевой промышленности при превращении жидких пли низкоплавких ненасыщенных масел в твердые пищевые жиры и маргарин. Эта так называемая реакция гидрогенизации (присоединения водорода) к двум атомам углерода при двойной связи приводит к тому, что данный участок углеводородной цепи, а следовательно, и вся углеводородная цепь, становится полностью насыщенным.
Хроматография. Существует много способов определения состава жиров и масел. Как и при определении состава углеводов (см. стр. 47), первая стадия обычно начинается с расщепления молекулы на части; при анализе глицеридов — с расщепления на глицерин и смесь жирных кислот. Сложноэфирную связь между глицерином и жирными кислотами легко расщепить с помощью гидролиза разбавленными растворами кислот или щелочей. Кислый гидрозил дает жирные кислоты, а щелочной — соли жирных кислот. Гидролиз разбавленным раствором едкого натра приводит к образованию натриевых солей жирных кислот (стеарата натрия, олеата натрия и т. п.). После расщепления жиров или масел гидролизом необходимо разделить смесь образовавшихся жирных кислот и идентифицировать их, чтобы получить данные о структуре конкретного гидролизуемого жира.
Одним из самых используемых методов, которые имеются в распоряжении биохимиков, для разделения смесей жирных кислот является хроматография. Название метода происходит от греческого слова «хрома», что означает цвет. Хроматография была разаработана после того, как русский ботаник Цвет заметил, что при пропускании через колонку, наполненную порошком окиси алюминия, растворов растительных пигментов появляются различные окрашенные полосы. Каждая полоса соответствует одному из компонентов смеси; можно разрезать колонку и экстрагировать эти компоненты из соответствующих полос. В настоящее время большинство веществ, разделяемых с помощью хроматографии, вовсе не окрашено, и название отражает только историю открытия метода. Разделение компонентов данной смеси основано на их взаимодействии одновременно с двумя различными фазами — стационарной и подвижной.

Рис. 20. Хроматография на бумаге, используемая для разделения смесей липидов на отдельные компоненты
В стеклянной колонке роль стационарной фазы играет окись алюминия, а растворитель со смесью пигментов представляет собой подвижную фазу. По мере того как подвижная фаза с исследуемой смесью проходит через стационарную фазу, все компоненты смеси контактируют с частичками окиси алюминия, и некоторые из них задерживаются на определенное время; остаток исследуемой смеси движется дальше. Те молекулы, которые отстали от общего потока подвижной фазы, могут следовать далее только после освобождения от стационарной фазы. Но как только они покидают первый участок стационарной фазы, следующий участок этой фазы захватывает их; таким образом, они все больше отстают от основного потока смеси. Все эти захватываемые молекулы представляют собой один из компонентов смеси, и он оказывается отделенным от общей смеси. Затем молекулы второго компонента оседают на окиси алюминия и тоже отстают от основного потока. По мере продвижения исследуемой смеси вдоль стационарной фазы постепенно все компоненты оседают на ней, и к моменту достижения подвижной фазой конца стационарной различные компоненты оказываются разделенными на отдельные полосы. Если теперь пропустить через колонку чистый растворитель, то каждый компонент будет вымываться в виде раствора; можно разрезать колонку на кольца и затем вымывать отдельные компоненты подходящим растворителем.
Есть и более простой метод хроматографии, в котором вместо стеклянной колонки с окисью алюминия в качестве стационарной фазы используется фильтровальная бумага. Небольшое пятно исследуемой смеси наносится на конец фильтровальной бумаги, который затем помещается в подходящий растворитель. Растворитель начинает двигаться вдоль фильтровальной бумаги, и, достигнув пятна исследуемой смеси, растворяет и уносит его компоненты далее. Разделение происходит точно так же, как и на колонке, поскольку волокна бумаги захватывают и удерживают отдельные компоненты смеси подобно окиси алюминия. К тому времени, когда фронт движущегося растворителя достигнет конца фильтровальной бумаги, разделение будет закончено (рис. 20). Для того чтобы предотвратить дальнейшее продвижение компонентов, бумагу быстро высушивают. Теперь компоненты смеси можно увидеть в виде отдельных пятен, находящихся на различном расстоянии от начального пятна. В тех случаях, когда эти пятна невидимы, их проявляют, например, окрашивая или облучая ультрафиолетовым светом — в зависимости от состава исследуемой смеси.
После разделения смеси с помощью хроматографии на бумаге идентифицировать все ее компоненты уже нетрудно. Расстояние, на которое удален компонент смеси от исходного пятна характерно для каждого конкретного соединения при соблюдении определенных условий (тип растворителя, характер стационарной фазы и т. п.). Таким образом, измеряя расстояние удаления компонента от исходного пятна и сравнивая полученное значение с данными для известных соединений, можно идентифицировать исследуемое пятно (или полосу).
Метод хроматографии, в котором используются твердые стационарные и жидкие подвижные фазы, оказался очень полезен для разделения смесей различных липидов. Но для разделения смесей жирных кислот вместо твердой стационарной фазы была использована жидкая фаза, нанесенная на внутренние поверхность тонкой стеклянной трубки (колонки), а вместо жидкой подвижной фазы — ток газа, пропускаемого через колонку под постоянным давлением. Такой метод называется газожидкостной хроматографией. При существенном отличив, используемых фаз механизм разделения компонентов исследуемой смеси остается тем же. Метод газожидкостной хроматографии, естественно, может быть использован также и для разделения сложных смесей других биохимических соединений.
Мыла. Гидролиз триглицеридов, о котором говорилось выше, — это способ превращения этих соединений снова в глицерин и жирные кислоты, а при щелочном гидролизе — в соли жирных кислот. Щелочной гидролиз триглицеридов лежит в основе одной из важнейших реакций класса липидов, называемой омылением, а натриевые и калиевые соли прямоцепочечных жирных кислот, образующиеся в этой реакции, называются мылами. Обычно мыло, которым мы пользуемся, состоит в основном, из стеарата натрия; его получают путем омыления говяжьего жира растворами едкого натра.
Очищающие и обезжиривающие свойства мыла обусловлены структурой его молекул. Длинные углеродные цепи углеводородов нерастворимы в воде и не диссоциируют в ней на ионы; углеводородные участки в молекулах мыла называют неполярной областью. Солевой конец молекулы мыла, наоборот, диссоциирует с образованием положительного иона натрия. Этот участок молекулы называют полярным, и благодаря его растворимости в воде вся молекула мыла целиком приобретает растворимые свойства. При контакте мыла с жирным загрязнением углеводородный неполярный участок молекулы растворяется в жире, но поскольку полярный конец остается свободным, весь комплекс в целом способен растворяться в воде, способствуя тем самым удалению загрязнения. Наличие полярных и неполярных участков в одной и той же молекуле — очень важное свойство; оно еще встретится нам при обсуждении некоторых липидов.
Интересно, что процесс производства мыла известен человечеству с давних пор, когда вместо гидроокиси натрия для омыления использовали вытяжки древесной золы, содержащие натриевые и калиевые карбонаты (мягкие основания).
В повседневной жизни мы сталкиваемся и с другим свойством жиров — их окислением. При контакте с воздухом насыщенные жиры окисляются и некоторые простые связи переходят в двойные. Жир становится из твердого жидким, так как температура плавления его понижается вследствие образования двойных связей. А это и есть первая стадия процесса прогоркания масел; следующая стадия процесса — гидролиз части сложноэфирных групп с образованием свободных жирных кислот, в три числе неприятно пахнущей масляной кислоты, которая сообщает прогоркнувшему маслу характерный запах.
Жиры и масла живых организмов. В живых организмах жиры и масла выполняют две главные функции: образуют пищевые запасы организма и являются структурными компонентами его тканей. Хотя они и не так широко распространены в природе, как глюкоза и другие моносахариды, их калорийность вдвое выше, чем у углеводов. Следовательно, при потреблении жиров организм получает значительно больше энергии, чем при потреблении сахаров. Жир — самый богатый энергией пищевой продукт, он способен откладываться в организме в качестве резерва, на случай необходимости. Пища, которая поступает в избыточном количестве в данный момент (не только сами жиры, но и углеводы, и белки), превращается организмом в жир и откладывается в определенных депо организма. В случае недостатка в пищевом материале организм тратит свои запасы, находящиеся в уже готовой для использования форме.
Жировые резервы организма могут нести и другие функции. Они окружают наиболее важные и нежные органы, такие, как почки и печень, создавая защитную преграду против внезапного удара. Правда, неизвестно, появилась ли защитная функция жиров в процессе эволюции или возникла случайно на какой-то ее стадии.
Структурные функции простых жиров немногочисленны, но жизненно важны. Липиды (жиры) находятся во многих тканях, в том числе в биологических мембранах, например в мембранах, отделяющих кровяные тельца от плазмы крови. Липиды является как бы мостиком между водорастворимыми и водонерастворимыми фазами. Вот для этой функции их полярно-неполярный характер представляет особую ценность; такую же роль выполняют и некоторые другие, сложные, липиды, которые будут обсуждаться в следующих разделах.
Воска. Последние из класса простых липидов — воска — встречаются, например, в покровах листьев некоторых вечнозеленых растений. Воска тоже принадлежат к сложным эфирам, только в их состав входит не глицерин, а одноатомный спирт с длинной углеродной цепью. Так, пчелиный воск состоит главным образом из сложного эфира пальмитиновой кислоты с мирициловым спиртом, который имеет формулу СН3— (СН2)29— ОН, т е. представляет собой прямую неразветвленную цепь из 30 углеродных атомов с первичной гидроксильной группой на конце. Воска, образующие налет на цветочных лепестках, кожуре грунтов и листьях, состоят из сложных эфиров высших жирных кислот с длиной цепи от 24 до 35 атомов углерода и длинноцепочечных первичных и вторичных спиртов.

Рис. 21. Составляющие некоторых сложных липидов
Сложные липиды — фосфолипиды. Сложные липиды, как это следует из их названия, имеют гораздо более сложную структуру, чем жиры, масла и воска. Кроме спирта и смеси жирных кислот, сложные липиды содержат и другие группы: остатки фосфорной кислоты и азотистых оснований, углеводы и белки. Рассмотрим сначала группу липидов на основе глицерина, называемых фосфолипидами.
Природные фосфолипиды образованы производными фосфатидной кислоты, в которой остаток фосфорной кислоты связан с гидроксильной группой глицерина посредством сложноэфирной связи. Фосфатидная кислота редко встречается в свободном виде в организме животных, но содержится в растениях, например в капусте. Если в фосфатную группу этого соединения ввести азотистое основание, то получим фосфолипид. Если азотистое основание — холин, липид называют фосфатидилхолином, или чаще — лецитином; если основание — этаноламин, липид называют фосфатидилэтаноламином; если роль основания играет серин, липид называют фосфатидилсерином. Фосфатидилэтаноламины и фосфатидилсерины объединяются иногда под общим названием кефалины.
Различные представители внутри каждой группы соединений имеют при глицериновой молекуле углеводородные цепи разной длины. Это обычно остатки таких же длинноцепочечных жирных кислот, какие входят в состав простых липидов. Общим правилом для лецитинов является то, что углеводородный остаток, находящийся рядом с остатком фосфорной кислоты, должен быть ненасыщенным (олеиновая пли линоленовая кислота), а другой углеводородный остаток должен быть насыщенным (пальмитиновая или стеариновая кислота) (рис. 21).
В отличие от простых липидов, фосфолипиды не имеют никакого отношения к пищевым депо организма, однако играют очень важную роль в биологических структурах. Фосфолипиды содержатся в большом количестве в мозговой и нервной тканях; они могут составлять около 25—30% сухой массы мозговой ткани, что вдвое превышает их содержание в других тканях, например в печени.
Липиды биологических мембран. Роль фосфолипидов в биологических мембранах интересна во многих отношениях. Рассмотрение структуры фосфолипидов показывает, что все они имеют неполярные участки из длинных углеводородных цепей и в значительной степени полярные участки из фосфорной кислоты и азотистого основания, следовательно, некоторыми своими свойствами они напоминают мыла (см. рис. 21). Полярные участки молекулы фосфолипида способны растворяться в водной фазе. Биологические мембраны состоят из отдельных слоев липидного и белкового характера. Они окружают отдельные клетки живого организма и составляют основу всех мельчайших структур внутри этих клеток. Это — органеллы, ответственные за производство энергии и синтез разнообразных органических соединений, таких, как белки, а также за защиту клетки от вредных веществ и организмов путем выделения особых реагентов, которые атакуют и разрушают их.
Под электронным микроскопом видно, что все мембраны состоят из двух плотных слоев белкового вещества, внутри которых находится более светлая зона, образованная главным образом из липидов. Самая центральная зона мембраны представляет собой жировой материал, а белки являются очень полярными веществами, растворимыми в воде. Поэтому внутри мембраны появляется поверхность раздела двух фаз: жир — вода.
Биохимическая роль фосфолипидов в мембранах состоит в том, чтобы заполнить промежуток между полярными и неполярными участками. Углеводородный участок молекулы фосфолипида внедрен (можно считать даже растворен) в жировую область в центре мембраны, в то время как другой участок фосфолипидной молекулы (со стороны фосфатной группы и азотистого основания) самым тесным образом связан с белковым участком мембраны. Таким образом, фосфолипидная молекула в целом осуществляет связь между внутренним жировым слоем и внешним белковым слоем мембраны, «связывая» их и обеспечивая тем самым стабильность этих чрезвычайно важных биологических структур.
Сфинголипиды. Эти соединения отличаются от жиров, масел и фосфолипидов, поскольку они не являются производными глицерина. В основе их структуры лежит не трехатомный, а двухатомный спирт, имеющий еще и аминогруппу в углеродной цепи, — аминоспирт сфингозин. Это длинноцепочечная молекула, состоящая из 18 атомов углерода с двойной связью, атомы водорода при которой находятся в транс-положении. Гидроксильные группы расположены у первого и третьего атомов, аминогруппа находится при втором атоме углерода цепи. Большинство сфинголипидов называют сфингомиелинами. Название отражает их функцию в живых тканях, где они образуют миелиновую оболочку вокруг нервных волокон; формула одного из представителей сфингомиелинов представлена на рис. 21.
Необходимо отметить, что у сфинголипидов имеются еще и другие отличия от фосфолипидов. Жирная кислота соединяется в них не с гидроксильной группой, а с аминогруппой амино-спирта, образуя новый тип связи, а именно амидную (—CO— —NH—) связь. Такая связь образуется между карбоксильной группой и аминогруппой, когда гидроксил от карбоксильной группы и один из водородных атомов аминогруппы отделяются в виде молекулы воды. Поэтому механизм образования амидной связи не сильно отличается от механизма образования сложноэфирной связи. Сфингомиелин представляет собой 1-фосфорный эфир сфингозина; при гидроксильной группе в положении один в сфингозине имеется остаток фосфорной кислоты, который в свою очередь связан с молекулой холина (последнее соединение уже встречалось нам в составе лецитина).
Другие сложные липиды. К ним относятся липопротеины и гликолипиды. Липопротеины, как это следует из их названия, сотоят из липидной и белковой частей, причем липидная часть представлена в них теми фосфолипидами, которые чаще всего встречаются в мембранах живых тканей. В липопротеинах взаимодействие между липидами и белками осуществляется без участия ковалентных связей.
Гликолипиды, наоборот, являются тем классом соединений, в которых липидная и углеводная части связаны ковалентно. Комплекс гликолипида с фосфолипидами встречается во многих тканях, особенно в тканях мозга. Однако гликолипиды существенно отличаются от фосфолипидов и других сложных липидов, которые мы рассматривали выше, тем, что не содержат фосфора в своих молекулах. В живых системах наиболее широко распространены гликолипиды — цереброзиды и ганглиозиды.
Цереброзиды на первый взгляд подобны сфингомиелинам, однако остаток фосфорной кислоты и азотсодержащее основание (холин) замещены в них молекулой моносахарида (галактозы, реже глюкозы), соединенной гликозидной связью с гидроксильной группой при первом атоме углерода сфингозина. В цереброзиде жирная кислота, соединенная амидной связью с аминогруппой при втором атоме углерода, содержит 24 атома углерода. Она имеет либо двойную связь между вторым и третьим (считая от карбонильного углерода) атомами углеродной цепи, либо гидроксильную группу при втором атоме углерода. Структура ганглиозидов очень похожа на структуру цереброзидов (сфингозин, жирная кислота и углевод), но входящие в их состав углеводы значительно сложнее. Это обычно аминосахара или характерный для ганглиозидов моносахарид — нейраминовая кислота.

Рис. 22. Наиболее распространенные стероиды
Стероиды. Описание соединений, известных под названием стероидов, обычно помещают в главы, посвященные липидам, хотя, как это можно видеть из их структуры (рис. 22), они совершенно не похожи на собственно липиды. Класс стероидов включает ряд чрезвычайно важных соединений; среди них многие гормоны, которые контролируют все функции специфических органов живого организма, а также совместно с жирами и сложными липидами входят в структуру биологических мембран. Стероиды, в сочетании с моносахаридами образуют лекарства и яды.
Структурной основой стероидов является сложная карбоциклическая система, которая называется циклопентаипергидрофенантреном. Хотя такое название и отражает все, что следует знать о структуре данного соединения (что оно состоит из четырех колец, три из которых являются шестичленными и одно пятичленным), гораздо проще применять его обычное название — стерановый цикл. В основном скелете самого стерана каждый углеродный атом содержит максимальное число атомов водорода, т. е. он является полностью насыщенным соединением. Разные стероиды отличаются наличием разнообразных заместителей в различных положениях основного скелета, а также длиной углеродной боковой цепи в положении 17 циклической системы. Кроме того, в положениях 10 и 13 основного цикла имеются еще две метильные СН3-грушш, атомы углерода этих групп нумеруются 19 и 18 соответственно. Атомы боковой углеродной цепи нумеруются от 20 и далее, в боковой цепи обычно содержится от 2 до 11 атомов углерода. В качестве других функциональных групп имеются гидроксильная и карбонильная группы; возможны различные варианты положена двойной связи — либо в кольце, либо в боковых цепях.
Представителем одного из классов стероидов — стеринов является холестерин. Молекула холестерина имеет гидроксильную группу при третьем атоме углерода циклической системы, в также боковую цепь из 8—10 атомов углерода; всего холестерин содержит 27, а его боковая цепь — 8 атомов углерода. В соединении с фосфолипидами он обеспечивает мембране более высокую устойчивость, чем это было бы возможно только с помощью фосфолипидов. Из холестерина в организме синтезируется ряд важных гормонов. Больше всего холестерина содержится в крови, молоке и яичном желтке.
Половые гормоны, имеющие структуру стеринов, в организме ответственны за развитие вторичных половых признаков (волосяного покрова, тембра голоса, молочных желез). Среди них могут быть молекулы, содержащие 21 атом углерода (с короткой боковой цепью), 19 (без боковой цепи) или 18 атомов углерода (без боковой цепи и метильной группы при десятом атоме На рис. 22 представлена структура мужского полового горкою тестостерона и женского полового гормона эстрона. Интересно, что принципиальное различие между двумя важнейшими гормонами, определяющими различие между мужчиной и женщиной, заключается в наличии дополнительной метильной группы и в положении в кольце карбонильной и гидроксильной групп. Один из гормонов (эстрон) имеет в одном из колец чередующиеся двойные и простые связи, как в бензольном кольце. Поэтому гидроксильная группа в его молекуле имеет свойства скорее фенольной, чем простой спиртовой группы, как в других гормонах.
Некоторые стероиды связаны с углеводами с помощью гликозидной связи, они называются стероидными гликозидами. Их высоко ценят как лекарственные препараты, поскольку в малых дозах они оказывают положительное влияние на сердечную деятельность; в более высоких дозах они весьма ядовиты.
Огл. Аминокислоты и белки
Белки, вероятно, являются наиболее важными и, конечно, наиболее подвижными из всех химических соединений живой материи. Большая часть структуры живых организмов состоит из белков, на их долю приходится около половины всей сухой массы тела человека и животных. Едва ли найдется ткань живого организма или какой-то вид биологической организации, где бы они не принимали участие. О белках часто говорят, что, с точки зрения биологии, они могут делать абсолютно все, и уже поэтому белки являются наиболее интересными из всех обсуждаемых в данной книге соединений.
Основные группы белков. Число возможных белковых молекул просто астрономическое. Причина такого явления будет обсуждаться ниже. Однако в принципе белки можно разделить на две группы. Несомненно, самые распространенные — белки, молекулы которых представляют собой длинные волокна (фибриллы); они используются природой в качестве структурного материала: входят в состав мышц, кожи, нервных волокон и сухожилий. Так, белок, называемый коллагеном, находят в сухожилиях, он принимает участие в обеспечении устойчивости скелета животных. Волосы и ногти тоже почти полностью белковый материал, состоящий из длинных волокнистых структур.
У другой группы белков молекулы свернуты в сферические структуры; их называют глобулярными белками. Они распространены меньше, чем фибриллярные белки, но являются, пожалуй, еще более важными, поскольку контролируют повседневную работу химической машины жизни. К ним относятся антитела — вещества, которые помогают защищать нас от болезней, отыскивая и дезактивируя вредные бактерии. Белковую природу имеют также некоторые гормоны: например, стероидные гормоны, о которых шла речь в предыдущей главе, регулируют работу целых систем и отдельных органов.
Особая роль принадлежит глобулярным белкам, называемым ферментами. Без них весь комплекс биохимических реакций, ассоциируемый с самой жизнью, протекал бы чрезвычайно медленно; возможно даже, что жизнь, основанная на таких медленных реакциях, вообще не могла бы существовать. Когда химик хочет какую-то конкретную реакцию провести быстрее, чем она протекает при нормальных условиях, он добавляет к ней так называемый катализатор, т. е. вещество, которое ускоряет реакцию, но само не принимает в ней участия и не изменяется в процессе реакции. Ферменты как раз и являются биологическими катализаторами: живые организмы используют их, чтобы поддерживать или ускорять биохимические реакции. Без ферментов жизнь вообще остановилась бы, они катализируют все реакции, в которых организм создает молекулы и структуры жизни. Исключение не составляют также и те реакции, в которых синтезируются сами ферменты.
Само название «белки» (или протеины) отражает их чрезвычайное значение. Для названия этих веществ еще в 1838 г. голландский ученый Мюльдер использовал греческое слово «протос», что означает «первичный»; таким образом, он первый распознал их важнейшую роль в протекании жизни. С тех пор белки всегда вызывали огромный интерес большого числа ученых, поэтому к настоящему времени об их сложной структуре и функциях известно уже довольно много.
Аминокислоты. Белки, как и полисахариды, представляют собой длинные цепи из более простых и меньших по размеру молекул, соединенных друг с другом. Строительные блоки для белковых макромолекул называют аминокислотами. Прежде чем перейти непосредственно к белкам, следует рассмотреть более простые соединения и понять их структуру и функции. Аминокислоты содержат углерод, водород, кислород, азот, а иногда и серу. В чистом виде они представляют собой белые порошки со слабым, но характерным запахом. Как правило, аминокислоты растворимы в воде и нерастворимы в органических растворителях, имеют высокую температуру плавления; обычно плавление сопровождается разложением аминокислоты.
Аминокислоты, как указывает само название, — органические молекулы, имеющие два типа функциональных групп — кислую карбоксильную группу и основную аминогруппу. Конечно, любая органическая молекула, которая содержит оба типа этих групп, может быть по праву названа аминокислотой, однако, говоря о белках, имеют в виду только a -аминокислоты с аминогруппой при том же атоме углерода, при котором находится и карбонильная группа. Свойства заместителя (R-группы) при том же атоме углерода определяют структуру и свойства конкретной аминокислоты. По этой группе, обычно называемой белковым заместителем (или боковой цепью), и классифицируют аминокислоты.
Открытие аминокислот датируется 1806 г., когда из сока аспарагуса было выделено первое из этих соединений, которое так и назвали аспарагином. Из белкового материала первую аминокислоту получили в 1820 г. При расщеплении белка жёлатина и разделении смеси продуктов было обнаружено, что большая часть смеси состоит из аминокислоты, которую назвали глицином из-за ее сладкого вкуса. Это было чистым совпадением, что в качестве первой аминокислоты, полученной в кристаллическом виде из белков, оказался именно глицин — простейшая из аминокислот, встречающихся в белках.
За период с 1820 по 1935 гг. из белковых материалов было выделено еще 18 аминокислот; таким образом, число достигло 20. Названия им давали по мере выделения совершенно произвольно, почти не учитывая их химические свойства и структуру. Постепенно в химии и биохимии обычные, или тривиальные, названия органических соединений были вытеснены систематическими названиями, описывающими данное соединение с химической точки зрения. Однако укоренившиеся названия аминокислот так и остались и до сих пор используются куда чаще, чем их химические названия. После 1935 г. из обычных белковых материалов не было получено ни одной аминокислоты, но из небелковых соединений выделено несколько новых представителей аминокислот.
Изомерия. В самой простой аминокислоте — глицине — R-группой является просто атом водорода; во всех других аминокислотах боковая цепь более сложная. Поэтому центральный атом углерода, при котором находятся карбоксильная группа, аминогруппа и один атом водорода, а также боковая цепь, является асимметрическим углеродом. Таким образом, все аминокислоты, за исключением глицина, имеют оптические D- или L-изомеры, как и моносахариды. Конфигурация аминокислот определяется по отношению к конфигурации D-глицеринового альдегида.
Экспериментально было доказано, что аминокислота серин принадлежит к L-ряду аминокислот. Поскольку в природных молекулах представлены только члены одного из двух возможных рядов изомеров, было принято, что все аминокислоты, присутствующие в белках, относятся к L-ряду. Следует еще раз напомнить, что принадлежность аминокислот к определенному ряду ничего не говорит об отношении данной молекулы к плоскости поляризации: различные L-аминокислоты вращают плоскость поляризации света либо влево, либо вправо. Направление и степень вращения определяются для каждой конкретной аминокислоты природой заместителя R в молекуле. Хотя белковые молекулы состоят только из аминокислот L-ряда, в природе все же существуют несколько D-аминокислот; они содержатся в клеточных стенках отдельных бактерий, но никогда не встречаются в белковых продуктах.
В молекулах некоторых наиболее распространенных аминокислот, например треонина, имеются даже два асимметрических атома. Как известно из главы, посвященной моносахаридам, число возможных оптических изомеров равно 2n, где п — число асимметрических атомов углерода в молекуле. Следовательно, для аминокислот типа треонина может существовать 22, или 4, оптических изомера. Но, по-видимому, природа предпочитает иметь дело только с одним каким-то изомером, и из четырех возможных (для нескольких аминокислот) только один изомер встречается в молекулах обычных белков.
Классификация аминокислот. Существует несколько способов классификации аминокислот, и все они основаны на различиях в боковой цепи и в структуре молекулы в целом. Остановимся на одном из них, согласно которому все аминокислоты могут быть разделены на три группы. К первой группе принадлежат аминокислоты с алифатическим заместителем R, представляющим собой углеводородную цепь с функциональной группой (или без нее). В молекуле членов второй группы аминокислот имеется бензольное кольцо. К третьей группе относятся более половины всех известных аминокислот; эта группа подразделяется на подгруппы в зависимости от функцнональной группы в алифатической боковой цепи. При чтении данного раздела рекомендуется пользоваться рис. 23, в котором приводится структура каждой аминокислоты.
В первой подгруппе третьей группы приведены моноамино-монокарбоновые кислоты, содержащие по одной из данных функциональных групп. У глицина нет боковой цепи, в качестве заместителя он содержит атом водорода. Аланин, валин, лейцин и изолейцин содержат в боковой цепи углеводородный остаток, причем у последних трех аминокислот углеводородная цепь разветвленная. У серина и треонина в боковой цепи находится гидроксильная группа. Такие аминокислоты этой подгруппы, как треонин и изолейцин, имеют по два асимметрических атома и способны к образованию четырех изомеров, хотя, как уже упоминалось выше, только один из этих изомеров встречается в белках.
В боковых цепях аминокислот следующей подгруппы присутствует карбоксильная группа, поэтому они называются моноаминодикарбоновыми кислотами. При растворении в воде эти кислоты (аспарагиновая и глутаминовая) будут обнаруживать слабокислые свойства благодаря наличию второй карбоксильной группы; их часто называют кислыми аминокислотами. Во вторую подгруппу также включены амиды этих аминокислот — аспаргин и глутамин (амиды — это производные карбоновых кислот, в которых гидроксил в карбоксильной группе замещен на аминогруппу).
В третьей подгруппе представлены основные аминокислоты. Их называют основными потому, что они имеют в боковой цепи вторую аминогруппу. Поэтому, следуя принятой классификации, их можно назвать диаминомонокарбоновыми кислотами. В белках имеются только две такие аминокислоты: лизин и аргинин.
Четвертая, последняя подгруппа, интересна тем, что ее представители содержат серу; таких аминокислот две — метионин и цистеин. В реакции окисления сульфгидрильная группа SH на конце боковой цепи молекулы цистеина способна взаимодействовать с такой же группой второй молекулы цистеина, при этом происходит отщепление двух атомов водорода и соединение двух атомов серы между собой с образованием так называемого дисульфидного мостика. Получается молекула другой аминокислоты, которая называется цистином и играет, как мы увидим ниже, важную роль в строении белковых молекул.




Рис. 23. Двадцать аминокислот, выделенные из белковых ееществ
Две первые группы аминокислот можно рассматривать вместе. В молекулах фенилаланина и тирозина содержится ароматическое кольцо. Кроме того, тирозин имеет еще гидроксильную группу в ароматическом кольце. Эти аминокислоты, как и одна из гетероциклических кислот — триптофан, способны к поглощению ультрафиолетового света. Поэтому, если ультрафиолетовые лучи интенсивно поглощаются образцом белка, можно с уверенностью сделать заключение о наличии в его структуре именно этих аминокислот. Другой представитель гетероциклических аминокислот — гистидин. Последняя аминокислота — пролин — циклическая аминокислота, ее аминогруппа входит в состав кольца; следовательно, пролин имеет вторичную аминогруппу вместо первичной, как у всех других аминокислот. Пролин иногда называют иминокислотой, но это уже устаревшее и приводящее к путанице название.
Такова классификация аминокислот, учитывающая структуру их боковых цепей. Иногда используют и другую классификацию аминокислот, основанную на их роли в питании. Хотя живые организмы и синтезируют аминокислоты (их называют заменимыми), существует все же несколько аминокислот, которые животные и растения не могут синтезировать самостоятельно, а должны получать готовыми с пищей и сразу использовать их для построения своих белковых молекул. Такие аминокислоты называют незаменимыми. Человеческий организм, например, не может синтезировать валин, лизин, треонин, лейцин, изолейцин, триптофан, фенилаланин, гистидин, аргинин и метионин; следовательно, он должен получать данные аминокислоты с пищей. Животная пища, такая, как мясо, рыба, яйца, сыр, содержит белки, которые составлены из всех рассмотренных выше аминокислот, поэтому такие белки называют полноценными. Растительная пища, наоборот, содержит мало полноценных белков, в них не хватает лизина, треонина и триптофана. Значит, по соображениям здоровья, человек должен включать в свой рацион обязательно и животные продукты; строгие вегетарианцы, не потребляющие даже яиц и молока, лишают свой организм незаменимых аминокислот.
Свойства аминокислот. Свойства аминокислот определяются структурой их боковых цепей и присутствием амино- и карбоксильной функциональных групп. Боковые цепи могут быть почти инертными, как, например, углеводородные цепи представителей первой подгруппы аминокислот, но могут быть и высоко реакционноспособными. Например, сульфгидрильная группа цистеина может образовывать дисульфидные мостики. Вторая карбоксильная группа аспарагиновой и глутаминовой кислот сообщает молекулам кислые свойства и, следовательно, способность взаимодействовать с основаниями с образованием солей. Лизин и аргинин обладают основными свойствами, которые обусловлены присутствием второй аминогруппы, тоже способной к образованию солей. Все эти свойства боковых цепей становятся еще более важными, когда аминокислоты объединяются в длинные макромолекулы.
Цвиттерионы. За некоторым исключением аминокислоты растворимы в воде, но не растворимы в эфире, ацетоне и других органических растворителях, хотя следовало бы ожидать обратного, поскольку органические амины и кислоты в принципе растворимы в органических растворителях и нерастворимы в воде. Температура плавления органических кислот и аминов сравнительно низка, а аминокислоты плавятся только при высокой температуре, и молекулы их часто разлагаются при плавлении. Приведенное несоответствие с наблюдаемыми для аминокислот свойствами указывает на то, что это заряженные, полярные соединения. Аминокислоты в водных растворах могут реагировать и как кислоты, и как основания. Благодаря своей двойственной природе они могут рассматриваться как амфотерные соединения, обладающие и кислотными, и основными свойствами. Амфотерная природа аминокислот — результат ионизации обеих функциональных групп в их молекулах. В нейтральных водных растворах обе группы, аминная и карбоксильная. находятся в полностью диссоциированной форме. Карбоксильная группа диссоциирует на протон и анион, приобретая отрицательный заряд, а аминогруппа присоединяет протон и оказывается положительно заряженной. В такой форме молекула называется «цвиттерионом». Этот термин предложен Бьеррумом з 1923 г. и в переводе с немецкого означает «ионы обоих типов».
Если к нейтральному раствору аминокислоты добавить основание, то протон положительно заряженной аминогруппы будет реагировать с ионом гидроксила с образованием воды и аминогруппа станет незаряженной. Единственный отрицательный заряд на аминокислоте будет принадлежать аниону карбоксила и молекула в целом станет отрицательной. Если теперь пару электродов соединить с батареей и погрузить в раствор аминокислоты, то аминокислота будет двигаться в направлена положительно заряженного электрода. И наоборот, если добавить кислоту к нейтральному раствору аминокислоты, понизив его pH, то протоны минеральной кислоты будут реагировать с ионами карбоксила, нейтрализуя их с образованием незаряженных карбоксильных групп. Вся молекула приобретает положительный заряд за счет заряда аминогруппы и будет передвигаться в направлении отрицательно заряженного электрода. Эти реакцин отражены на рис. 24.

Рис. 24. В водных растворах аминокислоты существуют в виде набора ионных форм
Другие реакции аминокислот. В данном разделе рассмотрим только два типа реакций с участием аминокислот. Аминогруппа аминокислоты может вступать в реакцию с соединением, называемым 2,4-динитрофторбензолом, с образованием 2,4-диннтрофенильного производного — желтого кристаллического соединения. При взаимодействии аминокислот с другим реактивом называемым нингидрином, образуется продукт сине-фиолетового цвета. Образование окрашенных соединений используется для обнаружения аминокислот.
Карбоксильная группа аминокислоты реагирует с образованием обычных производных карбоновых кислот, например эфиров и солей. Но наиболее важной в биохимии реакцией является реакция с аминами, в результате которой возникают амиды. Кроме того, аминогруппы аминокислот участвуют в обычных реакциях, характерных для аминов, включая солеобразование и реакцию с карбоновыми кислотами с образованием амидов. Важность реакции взаимодействия карбоксильной и аминной групп с возникновением амидной — СО—NH — связи станет понятной, если учесть, что именно с помощью этой связи две аминокислоты могут соединяться друг с другом. Поскольку одна из аминокислот все еще имеет свободную карбоксильную группу, а другая— аминогруппу, следующие аминокислоты могут присоединяться к первой паре аминокислот, образуя длинные цепи белковых макромолекул.
Протеины, или белки. Амиды, полученные синтезом двух аминокислот, обычно называют пептидами, а амидную связь — пептидной связью. При образовании каждой пептидной связи из двух молекул аминокислот образуется одна молекула воды (за счет гидроксильной группы из карбоксила одной и водородного атома из аминогруппы другой аминокислоты). Протеины, или белки, — это длинные цепи аминокислот, соединенных пептидными связями. Как и в случае полисахаридов, точное число аминокислот, необходимое для образования белка, неизвестно. Цепь из нескольких аминокислот, обычно до десяти, называют олигопептидом; если аминокислот более десяти, то такую цепь называют полипептидом. А если цепь состоит из более чем 70 (некоторые считают, из более чем 100) молекул аминокислот, такое соединение называют белком. Многие белки содержат сотни или лаже тысячи аминокислот, их молекулярная масса достигает нескольких миллионов. Для того чтобы длинную аминокислотную цепь можно было бы считать белковой молекулой, необходимо выполнение определенного условия: такая цепь должна быть составлена только из L-форм молекул аминокислот.
Структура белковых молекул значительно сложнее, чеv структура всех рассмотренных выше биохимически важных молекул, и вот почему. У молекул белка различают четыре уровня структурной организации, называемых первичной, вторичной, третичной и четвертичной структурами.
Первичная структура белка. Для установления первичной структуры белка необходимо знать последовательность аминокислот в цепи. В разделе о полисахаридах (см. стр. 47) уже обсуждалось, что для установления их структуры необходимо знать, какие моносахариды присутствуют в цепи и в каком порядке. Но в том случае речь шла только о двух или трех различных моносахаридах; большинство макромолекул было построено из повторяющейся последовательности какого-то определенного дисахарида. В построении белковых макромолекул принимают участие все двадцать различных аминокислот, и нет никакой последовательности из определенных двух или трех звеньев.
Более того, сам порядок расположения аминокислот в белковой цепи имеет жизненно важное значение. Например, две аминокислоты, глицин и аланин, по-разному могут соединяться друг с другом: либо аминогруппа глицина образует пептидную связь с карбоксильной группой аланина, либо наоборот: в обоих случаях возникают разные соединения. Чем большее число различных аминокислот принимает участие в данной реакции, тем. естественно, больше возникает таких возможностей. Число пентапептидов (в образовании цепи участвует пять аминокислот из всех двадцати аминокислот равно нескольким миллионам, и все они будут разными соединениями. Если же говорить о белковых молекулах, которые имеют в цепях сотни аминокислот, то число возможных положений последних в цепи просто не укладывается в нашем представлении.
Очистка белков. Самой первой трудностью, с которой сталкиваются при определении первичной структуры белка, это получение чистых образцов. Стараться определить аминокислотную последовательность в белке, когда он находится в сложной смеси с другими белковыми веществами, это все равно, что пытаться найти определенный телефонный номер в телефонной книжке без алфавитного порядка. К тому же обычно трудно определить, полностью ли очищен белок. С течением времени критерии чистоты изменялись, и то, что считалось высокоочищенным белком всего несколько лет назад, сегодня оказывается смесью трех или четырех белковых соединений.
Существует несколько способов очистки белков, а также методов определения чистоты очищенного белка. Первый метод получения чистых белков — фракционированное растворение. Различные белки отличаются различной степенью растворимости в растворах определенных солей или в органических растворителях. Смесь белков можно растворить, например, в воде, а затем добавить соль: белки, нерастворимые в солевом растворе, сразу же осаждаются. Этот метод разделения белков применяется и по сей день, но для достижения высокой степени очистки конечных продуктов он не пригоден. Другой метод очистки белков — их центрифугирование, по которому различные белковые вещества разделяются в соответствии с их молекулярной массой (см. рис. 17). Этот метод, конечно, лучше, чем фракционированное растворение, но и он не позволяет получить конечные продукты достаточной чистоты.
Следующие более современные методы разделения белковых смесей — электрофорез и хроматография. Хроматография уже упоминалась в предыдущей главе (см. стр. 55). При тщательном подборе стационарной и подвижной фаз для каждой смеси и для каждого белка в отдельности можно получить довольно-таки чистые соединения. Процесс можно повторять несколько раз для каждого пятна или полосы, причем с каждым новым разделением белок получается все чище и чище.
Электрофоретический метод основан на наличии электрического заряда на белковой молекуле (рис. 25). В цепях полипептидов у аминокислот нет свободных амино- и карбоксильных групп, так как они участвуют в образовании пептидных связей. Поэтому поведение белков как электролитов зависит от ионизуемости боковых групп. Например, диаминомонокарбоновые кислоты имеют свободные боковые аминогруппы. В растворах эти аминогруппы присутствуют как положительно заряженные ионы, поскольку они принимают протон. У моноаминодикарбоновых кислот имеются свободные боковые карбоксильные группы; в растворах они теряют протон и потому несут отрицательный заряд. В макромолекулах белка содержится много отрицательно и положительно заряженных боковых групп. Поэтому суммарный заряд на макромолекуле в целом будет зависеть от соотношения числа этих групп. Поскольку каждый белок имеет разное число аминокислот в цепи, суммарный заряд на каждом компоненте смеси белков будет различным. Если пропустить электрический ток через такую смесь белков, то каждый белок будет перемешаться в направлении электрода в зависимости от величины электрического заряда: чем выше заряд молекулы, тем быстрее она будет перемещаться. Электрофорез и хроматографию сейчас в лабораториях применяют повседневно, по мере совершенствования этих аналитических методов степень разделения белковых соединений постоянно повышается.

Рис. 25. Разделение белковой смеси путем пропускания электрического тока (электрофорез)
После выделения белка из смеси следует убедиться в его чистоте. Для этого можно продолжить очистку, т. е. попытаться отделить другие компоненты смеси от белка, и когда «очищенный» белок уже не будет разделяться на компоненты, можно быть уверенным в чистоте белка. Для дополнительной проверки образец белка можно подвергнуть различным методам разделения, например хроматографическому разделению и электрофорезу, каждый раз при разных условиях. Однако при попытке установить степень чистоты белка важно быть чрезвычайно осторожным, поскольку белковые молекулы очень неустойчивы и их легко разрушить. Это будут уже не те белки, которые ожидали получить при разделении смеси, и объект исследования окажется просто утерянным.
Аминокислотный состав белков. Как только получен чистый белок, можно ставить вопрос о его первичной структуре. Сначала необходимо определить, какие именно аминокислоты входят в состав этого белка, и относительное количество каждой из них. Это можно сделать с помощью гидролиза белка. Наиболее распространен метод кислого гидролиза, когда все аминокислоты макромолекулы белка освобождаются неизменными (за исключением триптофана, разлагающегося с почернением и осмолением). При щелочном гидролизе разрушается ряд аминокислот: цистеин, серии, треонин и аргинин. Однако, используя оба типа гидролиза независимо друг от друга, можно все аминокислоты исследуемой цепи получить в свободном виде. Полученную смесь аминокислот разделяют на компоненты с помощью хроматографии, а затем определяют относительное содержание каждой из них. Аминокислоты — бесцветные соединения, поэтому для того, чтобы их увидеть, хроматограмму необходимо проявить, например, обработав нингидрином; при этом пятна различных аминокислот окрашиваются в сине-фиолетовые тона. Ценность таких результатов ограничена, поскольку ничего не известно о порядке взаимного расположения аминокислот в исходном белке.
Последовательность аминокислот в белках. На определение последовательности аминокислот в белковой молекуле химическими способами можно затратить годы, даже десятилетия. Методы исследования те же, что для исследования структуры полисахаридов (см. стр. 46): цепи расщепляют на более короткие фрагменты и определяют последовательность мономерных звеньев в каждом из них. В известном смысле исследование таким путем белковых молекул (по сравнению с полисахаридами) упрощается тем, что цепи белка не имеют разветвлений, все аминокислоты образуют прямоцепочечные молекулы. Правда, две и даже больше цепей могут быть связаны друг с другом во многих местах, но только не с помощью пептидной связи; именно эти мостики и определяют более высокую структурную организацию белка, которую мы будем рассматривать ниже.
При изучении первичной структуры белка очень важно определить, какие именно аминокислоты находятся на концах белковой цепи. Естественно, что каждая цепь имеет два конца, которые отличаются по тому, какая из функциональных групп остается свободной в конечной аминокислоте. Если это аминогруппа (карбоксильная группа данной аминокислоты занята в пептидной связи), то говорят об N-концевой группе (N - атом азота). Если это карбоксильная группа (аминогруппа данной кислоты занята в пептидной связи), то говорят о C-концевой группе (C-карбоксигруппа). Полипептидные цепи условились записывать всегда с N-конца, так что в молекуле Ала-Сер-Вал-Тре-Фен N-концевая группа — аланин, у которого аминогруппа свободна, а C-концевая группа — фенилаланин со свободной карбоксильной группой (принятое трехбуквенное сокращение для аминокислот см. на рис. 23).
Для определения N-концевой аминокислоты той или другой полепептидной цепи на белок действуют 2,4-динитрофторбензолом. Если затем разрушить цепь с помощью гидролиза, то 2,4-динитрофенилпроизводное желтого цвета легко отделить от остальной смеси, например хроматографически, а потом идентифицировать. Определить C-концевую аминокислоту более сложно, но и это можно выполнить с помощью ферментов, отщепляющих аминокислоты одну за другой именно с этого конца. Фермент смешивают с белком или полипептидом, потом свободные аминокислоты выделяют из смеси и идентифицируют. Конечно, этот способ тоже имеет недостатки, потому что, как только первая аминокислота от C-концевой группы, фермент отщепляет и следующую кислоту, поскольку она становится новой C-концевой аминокислотой; все же обычно удается остановить реакцию до отщепления второй аминокислоты.
Идентифицировав C- и N-концевые аминокислоты, необходимо затем установить, какие именно аминокислоты находятся между ними и в какой последовательности, и вот эта часть исследования действительно является трудоемкой. Первичную структуру белка установил в 1955 г. Сангер. Он работал с белковым гормоном — инсулином — веществом, которое считают небольшой белковой молекулой, скорее полипептидом (оно содержит только 51 аминокислоту); десятилетняя работа над установлением структуры белка завершилась открытием, за которое Сангер в 1959 г. получил Нобелевскую премию.
В основе работы Сангера лежит расщепление белковых цепей на небольшие фрагменты, определение аминокислотной последовательности в этих фрагментах, а затем составление из этих фрагментов теоретически вновь белковой молекулы. Удачей, конечно, оказалось то, что Сангер имел набор ферментов, способных расщеплять белковые цепи в определенных местах, например пептидные связи при основных аминокислотах (аргинине и лизине) или при ароматических аминокислотах (тирозине и фенилаланине). После того как фрагмент цепи отщеплен, его подвергают обычным методам разделения (с помощью хроматографии или электрофореза). Используя различные ферменты для нескольких образцов одного и того же белка, можно разрывать цепи в разных местах, перекрывая таким образом фрагменты всей белковой молекулы.

Рис. 26. Первичная, вторичная и третичная структуры белка (третичная структура белка трехмерна}
Определение последовательности аминокислот в фрагментах, конечно, более простая задача, чем работа с целой белковой цепью, но и она достаточно сложна. Обычный метод — это постоянное отщепление аминокислот с помощью ферментов или химических реагентов до тех пор, пока не станет известна последовательность в данном фрагменте и не будут установлены N- и C-концевые аминокислоты.
Конечная задача — составление из всех фрагментов общей картины макромолекулы белка. Если четыре фрагмента белковой цепи исследовали с помощью различных методов расщепления и получили, например, последовательности Фен-Вал-Арг-Сер, Вал-Арг-Сер-Глю-Гли, Арг-Сер-Глю и Глю-Гли-Асп-Тир, то разум но предположить, что где-то в макромолекуле имеется последовательность Фен-Вал-Арг-Сер-Глю-Гли-Асп-Тир. Однако это -последовательность только восьми аминокислот, и нужна еще очень большая работа для определения последовательности всех аминокислот во всей белковой цепи. А ведь точно неизвестно, что все четыре фрагмента из одной и той же части цепи: это придется установить дальнейшей фрагментацией цепи в других ее участках и определением последовательности аминокислот в новых фрагментах.
Вторичная и третичная структуры белков. Вторичную и третичную структурные организации белков можно рассматривать вместе, поскольку обе они определяют те способы, с помощью которых цепи складываются и удерживаются в виде определенных образований. Белковые макромолекулы вовсе не прямые цепи, они обычно свернуты и изогнуты; часто в состав молекулы входит не одна цепь. Те способы, с помощью которых цепи удерживаются совместно, и есть вторичная структура белка. Третичная структура относится к трехмерному строению макромолекулы в целом. Соотношение между всеми тремя уровнями организации белковых макромолекул представлено на рис. 26.
Наиболее плодотворный метод исследования, который собственно и привел к пониманию вторичной структуры белка, основан на дифракции рентгеновского излучения, которая наблюдается при прохождении излучения через исследуемое соединение в том случае, если это соединение имеет организованную структуру.
Два американских ученых, Полинг и Кори, изучили большое число рентгенограмм низкомолекулярных кристаллических амидов и по этим данным установили правила расположения соединений в упорядоченных структурах: наиболее прочные молекулы должны иметь максимальное число водородных связей —О—Н…О— и —N—Н…N—. Если аминокислотные цепи действительно составлены по этим правилам, то выполняются два условия: во-первых, две цепи находятся рядом и соединяются водородными связями и, вследствие тетраэдрической ориентации ковалентных связей атомов углерода, такие молекулы имеют вид пластинок; во-вторых, водородные связи возникают между определенными участками одной и той же цепи и вся молекула имеет вид спирали. В так называемых a -спиралях каждый виток образуется примерно четырьмя аминокислотами, и витки такой спирали удерживаются с помощью водородных связей между аминокислотными остатками верхних и нижних витков этой же спирали (см. рис. 26).
Водородные связи достаточно прочны, чтобы удерживать белковые молекулы в спиралевидной форме в твердом состоянии, но при растворении в воде молекулы белка могут раскручиваться и приобретать случайную, хаотическую структуру. Для того чтобы удержать молекулы в форме спирали, должны быть и другие связи. Следствием образования таких связей является организация молекулы, называемая третичной структурой белка. Наиболее важный тип ковалентной связи — дисульфидные мостики, образующиеся между двумя цистеиновыми остатками одной и той же полипептидной цепи. Так как остатки цистеина могут находиться на значительном расстоянии, две отдельные части белковой цепи соединяются друг с другом, благодаря чему и стабилизуется третичная структура макромолекулы. Дисульфидные мостики могут образовываться и между цистеиновыми остатками различных белковых цепей, удерживая тем самым вместе две цепи в стабильной структуре. Например, молекула инсулина состоит из двух отдельных цепей, два дисульфидных мостика удерживают эти цепи вместе; еще один S—S мостик имеется между двумя цистеиновыми остатками одной и той же цепи.
В образовании третичной структуры принимает участие и другой тип связи — так называемые солевые мостики, образованные кислыми функциональными группами одних и основными функциональными группами других аминокислот. Это могут быть и простые ионные взаимодействия любой заряженной группы одной аминокислоты и противоположно заряженной группы другой.
Реальные формы белковых молекул, как и силы, стабилизирующие эти формы, известны только для немногих белков. По форме белковых макромолекул различают два класса белков — фибриллярные и глобулярные. Фибриллярные белки, как это следует уже из их названия, состоят из длинных прямых цепей, свернутых в спирали, но, как правило, не закрученных вокруг своей оси. Макромолекулы именно этого типа образуют волосы и шерсть, волокна мышц и сухожилий; они являются структурными белками жизни. Поскольку эти молекулы имеют хорошо выраженную третичную структуру, их можно изучать с помощью метода дифракции рентгеновского излучения.
Глобулярные белки, наоборот, более сложны для изучения, так как именно в белках такого типа имеются очень сильные химические связи, приводящие к образованию сложных форм макромолекул. Наиболее очевидное различие между фибриллярными и глобулярными белками заключается в том, что фибриллярные белки в основном нерастворимы, а глобулярные белки хорошо растворимы в воде — их иногда так и называют «растворимыми белками».
Следует сказать несколько слов о биологических катализаторах — ферментах. Ферменты — глобулярные белки, и точная форма таких макромолекул жизненно важна для их функционирования, поскольку именно форма делает возможным их действие как катализаторов разнообразных процессов. Известен целый ряд механизмов каталитического действия ферментов, но в качестве примера рассмотрим только один (рис. 27). Роль фермента заключается в том, чтобы способствовать встрече двух молекул А и В; он выполняет эту задачу путем удерживания молекулы А на своей поверхности, а также последующего захвата молекулы В. После того как оба эти соединения встретятся на поверхности фермента и прореагируют друг с другом, фермент освобождается от образовавшейся молекулы С. Чтобы удерживать вещества А и В, на поверхности фермента существуют специальные области, которые комплементарны по отношению к каждому из этих соединений. Эти специальные области определяются именно формой макромолекулы белка, а следовательно, и наличием связей, которые сохраняют данную молекулу в определенной третичной структуре.

Рис. 27. Механизм ферментативного действия
Денатурация белка. Если третичная структура белка нарушена, то его свойства изменяются коренным образом. Ферменты, например, теряют свою способность действовать как катализаторы: они не могут больше удерживать определенные соединения и тем самым способствовать их взаимодействию. Глобулярные белки, растворимые в нормальном состоянии, становятся нерастворимыми. Например, яичный белок — хорошо растворимое соединение, но при нагревании разрушается его третичная структура и он становится нерастворимым, резиноподобным продуктом. Процесс разрушения третичной структуры и называется денатураций; она может протекать при различных условиях. Ее нежно наблюдать при изменении pH раствора, например, при добавлении уксуса в молоко растворимые белки становятся нерастворимыми и осаждаются в, виде творожной массы. Даже сильное встряхивание может денатурировать белок. Так, если взбивать яичный белок, он денатурируется, т. е. превращается в нерастворимую массу. Высокая чувствительность и нестойкость белковых макромолекул и объясняет, почему работа с ними в лаборатории требует такой большой осторожности.
Четвертичная структура белка. Некоторые белки имеют, кроме трех уровней своей структурной организации, еще и четвертичную структуру, которая характеризуется тем, сколько белковых молекул входит в состав «сверхбелка». В этих комплексах каждая белковая молекула представляет собой отдельную субединицу, хотя она сама может быть составлена из нескольких аминокислотных цепей. Примером белка с четвертичной структурой является гемоглобин, красный пигмент крови млекопитающих. В его структуре принимают участие четыре белковых макромолекулы, которые удерживаются друг возле друга с помощью солевых мостиков. Другим примером могут служить волосы, каждое волокно которых состоит из нескольких белковых молекул, имеющих вид спирали; эти молекулы, обвивая друг друга, образуют более сложную спираль.
Синтез даже простой белковой молекулы — очень сложная задача; пока человек не научился этому. Самые длинные цепи из аминокислот, которые удавалось получить, имели только 20—30 аминокислотных остатков. А вот живые клетки легко синтезируют эти сложные макромолекулы. Очевидно, клетки должны иметь не только механизмы для собирания этих аминокислот и соединения их друг с другом, но также и подробную информацию относительно самой последовательности, в которой аминокислоты должны быть построены в данную белковую макромолекулу. Эта информация должна переходить от поколения к поколению данного вида клеток, чтобы потомство могло производить те же самые белки и продолжать жизнь.
В последней главе книги описаны соединения, называемые нуклеиновыми кислотами; именно они и содержат в своей структуре информацию, необходимую для образования белков.
Огл. Нуклеотиды и нуклеиновые кислоты
Все соединения, которые рассматривались выше знакомы нам из повседневной жизни: углеводы а виде сахара или картофельного крахмала; жиры в виде сливочного или растительного масла или воска для свечей; белки в виде мяса, волос или ногтей. А вот соединения, которые будут рассматриваться в данной главе, вовсе не окружают нас в легко распознаваемой форме. Тем не менее нуклеиновые кислоты присутствуют в каждой отдельной живой клетке, они играют жизненно важную роль, контролируя ежедневную работу этой клетки. Можно без преувеличения сказать, что в них и заключается секрет жизни.
О существовании нуклеиновых кислот известно уже свыше ста лет, но только в течение последних десятилетий полностью стало понятно огромное значение этих соединений. Нуклеиновые кислоты имеют чрезвычайно сложную структуру, куда более сложную, чем структура белков. Они представляют собой длинные молекулы, составленные из субъединиц, в свою очередь состоящих из меньших по размеру компонент, вовсе не являющихся простыми соединениями, как, например, моносахариды или аминокислоты, которые входят в состав соответственно углеводов и белков. Далее, нуклеиновые кислоты — одни из самых больших молекул, известных человеку: некоторые из них имеют молекулярную массу, составляющую десятки и сотни миллионов. Именно в этих колоссальных макромолекулах и содержатся все инструкции, которые необходимы клетке для производства белка, т. е. согласно которым аминокислоты должны выстраиваться в полипептидные цепи. Таким образом, нуклеиновые кислоты представляют генетический материал живых клеток, который передается из поколения в поколение при их репродукции, благодаря чему потомки способны синтезировать те же белки, что и их предки.
Открытие нуклеиновых кислот. История открытия нуклеиновых кислот необыкновенно интересна — это история о научных исследованиях, которые привели к современному уровню знаний о структуре и функциях этих соединений. Сам процесс выяснения структуры нуклеиновых кислот был долгим и трудным. Многие ученые внесли свой вклад в общее дело, иногда верный, иногда неверный; и хотя отрицательные результаты в науке также ценны, как и положительные, проследим только успехи нескольких основных исследователей данной области.
Нуклеиновые кислоты были открыты в 1868 г. швейцарцем Фридрихом Мишером. После получения медицинского образования он решил заняться исследованием живых клеток. Используя в качестве исходного материала гной с больничных бинтов, он сумел выделить из ядра клеток гноя соединение, которое назвал нуклеином.
Позже Мишер, использовав для своих исследований сперму лососевых рыб, установил, что клетки спермы состоят почти целиком из ядер, а ведь именно из ядер клеток он выделил свой нуклеин. Анализируя нуклеин, ученый нашел, что он состоит из элементов углерода, водорода, кислорода, азота и фосфора, а также установил, что фосфор содержится в нуклеине в виде фосфорной кислоты. Но только на долю другого ученого, Альтмана, выпало показать, что нуклеин имеет кислые свойства; он и предложил в 1889 г. называть это соединение нуклеиновой кислотой, другим вкладом Мишера в науку, совершенно не замеченным в то время, было предположение о том, что именно нуклеин является тем генетически активным материалом, который присутствует в ядрах клеток спермы.
Еще до смерти Мишера в 1895 г. другие ученые начали исследовать природу нуклеиновых кислот. Так, в 1874 г. Пиккард обнаружил, что в состав нуклеиновых кислот из спермы лососевых рыб входит азотистое основание. Это было пуриновое соединение, бициклическая структура которого состояла из шестчленного гетероцикла с двумя атомами азота и пятичленного гетероцикла тоже с двумя атомами азота; соединение, которое открыл Пиккард, назвали гуанином. Позже было установлено, что в состав нуклеиновых кислот входят разные пуриновые основания, отличающиеся различными боковыми заместителями в гетероцикле.
В 1880 г. немецкий химик Фишер доказал, что в нуклеиновых кислотах имеются два типа азотистых оснований: пурины и пиримидины. Пиримидины — тоже гетероциклические соединения, состоящие только из одного гетероцикла с двумя атомами азота, аналогичного шестичленному циклу пуриновой молекулы: Несколько лет спустя Коссель выделил другое пуриновое основание — аденин и еще два пиримидиновых основания — тимин и цитозин. В начале XX века Асколи открыл еще одно пиримидиновое основание — урацил. Таким образом, в составе нуклеиновых кислот были идентифицированы пять азотистых оснований. Теперь мы знаем, что именно эти пять соединений и представляют азотистые основания в нуклеиновых кислотах. Иногда, правжда, присутствуют и другие основания, однако в небольшом числе случаев и в небольших количествах.

Рис. 28. Главными составляющими нуклеиновых кислот являются три пиримидиновых и два пуриновых основания, а также два моносахарида из класса пентоз
Так, выяснилось, что в состав нуклеиновых кислот входят азотистые основания и фосфорная кислота. Однако вплоть до 1910 года было неизвестно, как эти вещества соединяются друг с другом. В 1910 г. химик Левин из нуклеиновой кислоты, полученной из дрожжевых клеток, выделил молекулу сахара: это была пентоза, названная рибозой. Позже он обнаружил, что существуют два типа нуклеиновых кислот: один, содержащий в качестве углеводной компоненты рибозу, а другой — тоже пентозу, называемую дезоксирибозой. Кроме того, Левин высказал важное предположение, что углевод и азотистое основание объединены в общий комплекс, а уже эти комплексы соединяются с фосфорнокислым компонентом в длинные цепи. Углевод вместе с азотистым основанием стали называть нуклеозидом, а нуклеозид вместе с фосфатной группой — нуклеотидом. Именно нуклеотиды и являются строительными блоками длинных цепей нуклеиновых кислот.
К 1930 г. стало ясно, что существуют два определенных типа нуклеиновых кислот, которые отличаются не только характером сахарного компонента, но также и составом азотистых оснований. Первый был сначала найден только в растительных материалах, а потому был назван растительной нуклеиновой кислотой. Этот тип содержит моносахарид рибозу, фосфорную кислоту, два пуриновых основания (аденин и гуанин) и два пиридиновых основания (цитозин и урацил). Второй тип нуклеиновых кислот был выделен вначале из животных тканей, поэтому его и назвали животной нуклеиновой кислотой. В этой нуклеиновой кислоте вовсе не содержалось рибозы, вместо нее присутствовала дезоксирибоза, три основания — аденин, гуанин, тирозин — оказались идентичными найденным в растительной нуклеиновой кислоте, а урацил был замещен другим пиримидиновым основанием — тимином (рис. 28).
Деление нуклеиновых кислот на растительную и животную вскоре было отвергнуто, так как оказалось, что каждая клетка и растительного, и животного происхождения содержит оба типа нуклеиновых кислот. Поэтому названия нуклеиновых кислот изменились. Они отражают теперь характер присутствующего в кислоте углеводного остатка. Растительные нуклеиновые кислоты стали называть рибозными нуклеиновыми кислотами, или рибонуклеиновыми кислотами, сокращенно РНК. Аналогично животная кислота была названа дезоксирибозной нуклеиновой кислотой, сокращенно ДНК. В 40-х годах было установлено, что ДНК клетки локализована в ее ядрах, вот почему она и была выделена Мишером из ядер и названа нуклеином; РНК же находится главным образом в окружающей ядро цитоплазме.
Нуклеотиды. Структура строительных блоков нуклеиновых кислот одинакова как для РНК, так и для ДНК (рис. 29). Нуклеозиды состоят из молекулы моносахарида, присутствующего в пятичленной фуранозной форме и соединенного с одним из азотистых оснований через первый углеродный атом фуранозного кольца. Пурины присоединяются к моносахариду через атом азота в положении девять их колец; пиримидины присоединяются через атом азота в положении три их кольца. Пуриновые и пирамидиновые основания обычно не встречаются в свободном виде в природе, они почти всегда соединены с молекулой пентозы.
Нуклеозиды называют по основанию, учитывается также и углеводная компонента. Нуклеозиды, производные рибозы. называютт аденозином, гуанозином, цитидином. Нуклеозиды, производные дезоксирибозы, называют дезоксиаденозином, дезоксигуанозином, дезоксицитидином. Поскольку пиримидиновое основание — тимин — образует нуклеозид только с дезоксирибозой, данный нуклеозид называют тимидином.
Нуклеотиды можно рассматривать как фосфорнокислые эфиры нуклеозидов. В кольце рибозы имеются три возможных положения для присоединения фосфатной группы (при атомах углерода два, три и пять). Однако в природе только в положениях три и пять действительно образуются сложноэфирные связи с фосфорной кислотой. Нуклеотиды называют по нуклеозиду и по положению фосфатной группы, поэтому, например, аденозиновый нуклеотид с фосфатной группой при третьем атоме кольца фуранозы называется аденозин-3-фосфатом, а цитидиновый нуклеотид с фосфатной группой при пятом атоме углерода называется цитидин-5-фосфатом. В нуклеозидах с дезоксирнбозой в положении два фуранозного кольца имеется не гидроксильная группа, а лишь атом водорода, поэтому фосфатная группа может присоединяться к ним только в положениях три и пять кольца фуранозы.
Несколько нуклеотидов выполняют очень важные функции в организме, не являясь частью нуклеиновой кислоты. В таком случае к уже имеющейся фосфатной группе при пятом атоме углерода кольца фуранозы присоединяются еще две или три фосфатные группы, образуя нуклеотид-5-дифосфат или нуклеотид-5-трифосфат соответственно. Например, уридин-5-дифосфат присоединяясь к молекулам моносахаридов, образует уридиндифосфат сахара (их часто называют УДФ-сахарами), способные ко многим химическим превращениям в процессе метаболизма. Именно так нуклеотиды активируют сахара для разнообразные химических реакций; в этом случае их называют коферментами.

Рис. 29. Примеры нуклеотидов, показывающие, в каких положениях соединены молекулы моносахаридов, оснований и фосфатных групп (ГМФ — гуанозин-3-фосфат, дЦМФ — дезоксицитидин-5-фосфат)
Наибольшее значение из нуклеотидфосфатов имеет аденозин-5-трифосфат или сокращенно АТФ. Его молекулы способны сохранять большое количество энергии и освобождать ее, когда это требуется для химических реакций, протекающих в клетке. В органической химии и биохимии известен общий принцип: для осуществления реакций нужен внешний источник энергии, даже если реакции протекают в присутствии катализаторов или ферментов. В лабораторных условиях довольно просто организовать снабжение энергией, например, нагревая сосуд со смесью веществ, поступающих в реакцию. Для живой клетки это должна быть химическая энергия, получаемая организмом из пищи, например, из углеводов или жиров. Однако живые клетки не могут использовать всю поступающую извне энергию немедленно, ее нужно сохранить на какое-то определенное время в виде многочисленных, но небольших «порций». По мере необходимости в энергии для каких-то конкретных протекающих в организме реакций освобождается одна-две таких «порции». Эта энергия не пропадает даром и ее не нужно будет вновь сохранять, т.е. не будет необходимости в процессе, который сам требует затраты некоторого количества энергии.

Рис. 30. Двойная спираль молекулы ДНК; азотистые основания взаимодействуют друг с другом (справа) с помощью водородных связей
Энергия сохраняется в живых клетках в виде химической связи между второй и третьей фосфатными группами молекулы АТФ. Когда клетке требуется какое-то количество энергии, она расщепляет АТФ до аденозиндифосфата (АДФ), при этом освобождается не только определенное количество энергии, но и одна фосфатная группа. Химическую связь между двумя указанными фосфатными группами в АТФ иногда (и не совсем правильно) называют «высокоэнергетической связью», а молекулу АТФ — «универсальным топливом клетки». Если клетке необходимо сохранить энергию, например, полученную из пищи, то протекает обратный процесс присоединения фосфатной группы к АТФ и накопления энергии в виде связи между второй и третьей фосфатными группами в молекуле АТФ (см. рис. 29).
Полинуклеотиды. Когда нуклеотиды объединяются с образованием длинных цепей, обе гидроксильные группы углеводного компонента вовлекаются в образование фосфорнокислого эфира. Поэтому основной скелет полинуклеотидной цепи состоит из углеводных остатков, соединенных друг с другом фосфатными группами, которые как бы образуют мостики между третьим атомом углерода одного сахара и пятым атомом следующего и т. д. Азотистые основания располагаются перпендикулярно к основной цепи и связаны тоже с углеводным компонентом. Вот таким способом десятки, сотни и даже тысячи нуклеотидов соединяются, образуя цепи, которые и составляют макромолекулы РНК и ДНК.
Только это и было известно о полинуклеотидах в начале нашего столетия. Не было известно даже, сколько именно молекул нуклеотидов образуют макромолекулу каждой нуклеиновой кислоты, какие факторы определяют последовательность различных оснований в цепи, т. е. самих нуклеотидов. Следовательно, не была известна ни первичная структура, ни форма макромолекул, т. е. вторичная структура. Поскольку было установлено, что азотистые основания присутствуют примерно в равных количествах, было сделано предположение о том, что четыре различных нуклеотида сначала объединяются в тетрануклеотид. Однако по мере усовершенствования методов исследования оказалось, что четыре основания вовсе не присутствуют в равных количествах и что молекулярная масса полинуклеотидов значительно выше, чем это можно было предположить для тетрануклеотидов.
Строение ДНК. По мере того как улучшались методы выделения ДНК, стало возможным получать эти вещества без разрушения макромолекул, стало реальным и определение молекулярной массы. В начале 50-х годов уже было ясно, что молекулярная масса молекул ДНК достигает десяти миллионов и что они состоят примерно из 50000 нуклеотидных звеньев. В 1950 г. Чаргафф и его сотрудники проанализировали компоненты ДНК, которые они получали из многих источников, и вывели из полученных результатов определенные закономерности для структуры этих молекул. Они установили, что различные клетки и ткани имеют идентичный или, по крайней мере, очень похожий состав макромолекул ДНК. Во всех образцах ДНК число пуриновых оснований всегда равно числу пиримидиновых оснований, т. е. число адениновых звеньев равно числу тиминовых звеньев, а число цитозиновых звеньев — числу гуаниновых. Что означает такая регулярность, Чаргаффу выяснить не удалось, но без его «правил» окончательная расшифровка структуры ДНК была бы значительно сложнее.
В макромолекулах ДНК была обнаружена не только химическая, но и физическая закономерность. Эти соединения — кислоты и, естественно, они могут образовывать соли; например, натриевая соль ДНК может быть получена в виде длинных нитей. Такие волокна имеют кристаллическую структуру, поэтому ученые начали исследовать их с помощью дифракции рентгеновского излучения, как и структуру белков. Уилкинс установил, что в этих волокнах через каждые 34 А (один ангстрем равен 10-10 м) имеются повторяющиеся участки одного типа, а через каждые 3,4 А — повторяющиеся участки другого типа. Уилкинс измерил также плотность молекул ДНК и на основании полученных результатов сделал вывод, что каждая молекула ДНК состоит более чем из одной простой полинуклеотидной цепи.
Примерно в это же время Полинг и Кори высказали предположение о спиральной структуре белковых молекул, а потом и молекул ДНК. Однако их предположение было сделано для трех полинуклеотидных цепей, перевитых в общую спираль, а это не соответствовало ни правилам Чаргаффа, ни данным рентгено-структурного анализа. В 1953 г. Уотсон и Крик опубликовали данные об образовании двойной спирали ДНК, что находилось в согласии со всеми ранее полученными результатами и к тому же объясняло еще и многие функции нуклеиновых кислот. За эти работы оба ученых, совместно с Уилкинсом, получили в 1962 г. Нобелевскую премию. Предложенная ими структура, хотя и с некоторыми изменениями, является общепринятой и по сей день.
Двойная спираль Уотсона и Крика очень похожа на лестницу, которая перекручена вокруг центральной оси. Две «стойки» этой лестницы образованы основной цепью из углеводных и фосфатных групп, в то время как основания между цепями образуют «перекладины». Основание одной полинуклеотидной цепи связано с основанием другой с помощью водородных связей так, что две половинки «перекладины» образуют довольно прочное соединение. В такой структуре каждая пара оснований удалена друг от друга на 3,4 А, а каждый поворот спирали имеет высоту 34 А; это соответствует одному витку спирали из десяти нуклеотидов. Такое объяснение хорошо согласуется с данными рентгеноструктурного анализа (рис. 30).
Вазимодействие между пуриновыми и пиримидиновыми основаниями весьма специфично. Для того чтобы все звенья цепи нуклеиновой кислоты (сахара, фосфаты и основания) хорошо компоновались в спираль, аденин должен образовать пару только с тиминовым, а гуанин — только с цитозиновым основаниями. Если два пуриновых, больших по размеру, основания будут находиться друг против друга, то для них просто не окажется достаточно места внутри двойной спирали. Словом, имеется много запретов для различных комбинаций из пар оснований, кроме тех разрешенных, которые были упомянуты выше.
Таким образом, если аденин всегда находится в паре с тимином, то в макромолекуле должно быть одинаковое число этих оснований, а это как раз и согласуется с данными Чаргаффа. Сказанное распространяется также и на гуанин с цитозином: они всегда находятся в паре, и в макромолекуле их должно быть их равное количество. Одна цепь двойной спирали комплементарна другой, т. е. одна цепь с последовательностью оснований, например,: гуанин — цитозин—аденин — гуанин — тимин, всегда связана водородными связями с последовательностью оснований цитозин — гуанин — тимин — цитозин — аденин. Такое спепифическое спаривание оснований наблюдается вдоль всей макромолекулы. Другим следствием указанного строения цепи является то, что для образования водородных связей оба основания, да и сами цепи в целом, должны располагаться «вверх ногами» по отношению друг к другу.
Структура второй нуклеиновой кислоты, РНК, отличается от структуры ДНК: у них разные углеводные звенья и вместо пирамидинового основания тимина в состав РНК входит урацил. В РНК основания не спарены, так как данная макромолекула представляет собой одиночную цепь полинуклеотида, как бы половинку лестницы. По этой причине РНК не является спиральной молекулой по всей длине, некоторые ее участки имеют неправильную структуру в виде клубочков или складок.
Функции ДНК. В самом начале главы упоминалось, что в структуре нуклеиновых кислот заложены все инструкции для синтеза белков - каким путем и из каких аминокислот должна быть построена молекула данного белка. Мишер первым предположил, что нуклеин является генетическим материалом живой клетки, который должен находиться в самих ядрах клетки. Это предположение надолго забыли, лишь в 1944 г. Звери доказал что ДНК ответственна за перенос генетической информации. Эвери экстрагировал ДНК из штамма пневмококковых бактерий, которые имели капсулы вокруг клеток, а потому назывались «гладкими». Если вводить эту ДНК в клетки пневмококков, не имеющих капсул, то некоторые из потомков бактерии превращаются в гладкие клетки. Ясно, что именно ДНК ответственна за превращение обычных клеток в клетки с капсулами, именно она принесла новую генетическую информацию в клетки. Но механизм наследования информации клеткой оставался непонятным до публикации данных Уотсона и Крика относительно структуры ДНК.

Рис. 31. Генетический код (сокращения для аминокислот те же, что и в главе 5)
Уотсон и Крик объяснили способ, по которому информация может передаваться от поколения к поколению. Они предположили, что сама последовательность оснований вдоль цепи ДНК представляет закодированную информацию для построения аминокислот в белковых молекулах. Эта закодированная инструкция будет использована при синтезе белка в цитоплазме клетки, и, согласно именно этой инструкции, будут синтезироваться белковые молекулы со специфической последовательностью аминокислот.
Передача информации осуществляется тем же путем, по которому молекула ДНК копирует себя. Если две нити двойной спирали ДНК разделить на отдельные нити и добавить набор из четырех различных нуклеотидов, то нуклеотиды могут уложиться вдоль одиночной цепи по правилу Чаргаффа о спаренных основаниях. Если эти нуклеотиды затем соединятся и между комплементарными основаниями обеих цепей образуются водородные связи, то получатся две новые нити двойных спиралей ДНК. Каждая новая молекула будет содержать одну нить из первоначальной молекулы и одну вновь синтезированную, а каждая полученная таким образом двойная спираль ДНК будет идентична исходной двойной спирали. Та нить ДНК, которая была частью исходной молекулы и на которой нуклеотиды соединились друг с другом, называется «матричной» нитью, поскольку она служила моделью для расположения оснований комплементарной нити.
Двойная спираль ДНК может служить моделью и при синтезе молекул РНК. И в этом случае молекула ДНК разворачивается полностью, но только одна нить используется как модель для синтеза единичной нити РНК, и вместо тиминового нуклеотида, расположенного против аденинового основания в модели, в образующуюся макромолекулу РНК встраивается урацил. Оба описанных процесса происходят в живых клетках. ДНК синтезирует копии себе подобных молекул, которые переходят к следующим поколениям клетки при ее делении. А при синтезе молекул РНК существует специальный механизм, по которому закодированная инструкция с молекулы ДНК передается в цитоплазму клетки. Следует напомнить, что ДНК локализуется чаще всего в ядрах клетки, а РНК находится большей частью в окружающей из цитоплазме.
Генетический код. Остается рассмотреть, каким образом в структуре двойной спирали ДНК заключена генетическая информация и как эта информация передается при синтезе белка в цитоплазме. Уотсон и Крик предположили, что информация заложена в самой последовательности оснований в полинуклеотидной цепи. Имеются только четыре типа оснований, и именно они должны отобрать нужные из двадцати аминокислот.
Если именно расположение четырех оснований в макромолекуле ДНК будет определять последовательность аминокислот в белковой цепи (т.е. как аминокислоты расположатся вдоль нити РНК в цитоплазме), то тогда самой структурой нуклеиновой кислоты должны отбираться только четыре аминокислоты. Ясно, что этого недостаточно. Если выбор одной аминокислоты будет определять комбинации двух оснований, то это приведи к следующему. Четыре различных основания могут комбинироваться попарно шестнадцатью различными путями (4X4), на пример: АГ, АЦ, ГА, ЦА, АУ, АА, УА и т. д. Если в процессе синтеза белка в цитоплазме аминокислоты расположатся вдоль нити нуклеиновой кислоты так, что выбор каждой аминокислоты будет зависеть от пары оснований, то нуклеиновая кислота сможет обеспечить последовательность из шестнадцати амина кислот; тогда останутся неиспользованными в этой схеме еще четыре аминокислоты.
Существует третья возможность: положение каждой аминокислоты в структуре нуклеиновой кислоты будет определяться комбинацией из трех оснований. Четыре основания можно расположить в триплеты 64 различными способами (4x4x4). Это уже более чем достаточно для выбора аминокислот в процесс построения белковых молекул. Поэтому при синтезе белка в цитоплазме каждая аминокислота располагается вдоль цепи нуклеиновой кислоты против определенных трех оснований, после соединения аминокислотных остатков образуется белок строго в соответствии с расположением триплетов оснований в молекул нуклеиновой кислоты. Расположение триплетов оснований и называется генетическим, или триплетным, кодом. Все триплеты, а также аминокислоты, которым они соответствуют, представлены на рис. 31. Три из этих триплетов не являются кодовыми, они отмечены как «стоп»-триплеты. Находясь в начале или самом конце последовательности из триплетов, они отдают «приказ», когда начинать или когда кончать синтез данного конкретного белка. Если бы не было этих триплетов, то образовывались бы бесконечно длинные цепи из аминокислот, и клетка просто не знала бы, когда прекращать рост цепи, чтобы получился конкретный белок.
Синтез белка. Наконец, пора обсудить способ, по которому зашифрованная в генетическом коде информация переходит при синтезе белка в цитоплазму. С помощью двойной спирали ДНК ядер получается несколько различных молекул РНК, каждая со своей специфической задачей в белковом синтезе. РНК первого типа называется рибосомной РНК, она предназначена для синтеза частиц, называемых рибосомами, и являющихся главными фабриками» для производства белка. Молекулы рибосомной РНК довольно сильно скручены, поэтому они могут продуцировать почти сферические рибосомы. РНК второго типа называется информационной: последовательность оснований у нее комплементарна с той частью молекул ДНК, которая содержит информацию для синтеза конкретного белка. Само название данной РНК показывает, что ее молекулы ответственны за считывание зашифрованной инструкции с ядра в цитоплазму и рибосомы. РНК третьего типа называется транспортной; в этой молекуле два особых участка с совершенно определенными функциями. Один из участков как раз и представляет собой триаду оснований для синтеза конкретной аминокислоты. Другой участок транспортной РНК способен удерживать аминокислоту согласно триплету первого участка. Именно транспортная РНК ответственна за передачу генетического кода. Вместе с находящимися на ней аминокислотами, молекулы этой РНК располгаются вдоль нити информационной РНК, поэтому основания в триплетах обеих макромолекул могут образовывать пары по правилам Чаргаффа. Таким образом, триплет информационной РНК удерживает комплементарный триплет транспортной РНК, которая, в свою очередь, удерживает аминокислоту, характерную для данного триплета. Другая транспортная РНК с другим триплетом и другой аминокислотой удерживается затем на другом триплете информационной РНК, а потому эти две аминокислоты могут соединиться друг с другом. Когда первая транспортная РНК отходит от информационной РНК, следующая молекула транспортной РНК со своей аминокислотой подходит и добавляет свою аминокислоту к первым двум.
Все эти процессы происходят в рибосоме; и по мере того, как рибосома движется вдоль информационной РНК, подходят все новые транспортные РНК, образуют новые пары оснований с комплементарными триплетами информационной РНК, присоединяют свои аминокислоты к растущей белковой цепи, а затем отходят. За время продвижения рибосомы вдоль информационной РНК (или к тому времени, когда она достигает триплет «стоп») рибосома соберет все аминокислоты, необходимые для получения конкретного белка, к тому же в правильной последовательности, и соединит их в макромолекулу данного белка. Далее освободившийся белок принимает характерную для него вторичную и третичную структуру, а рибосома освобождается для того, чтобы найти новую информационную РНК и начать новый процесс синтеза другого белка.
Огл. Заключение
Перечислим снова все главные классы соединений, которые образуют живой организм, и реакции, по которым они взаимодействуют в процессе того, что мы называем жизнью. Нуклеиновые кислоты содержат всю информацию, которая необходима живым клеткам для образования всех компонентов; они контролируют синтез белка. А белок либо и есть сама частица клетки, либо является ферментом, управляющим всеми химическими реакциями расщепления и синтеза других веществ в живых клетках. Углеводы и липиды используются как строительный материал или как пищевые ресурсы, а следовательно, и как энергия. Абсолютно все перечисленные биохимические реакции находятся под контролем ферментов клетки. Все вместе они взаимосвязаны; это и называется метаболизмом, но данный предмет — тема уже совсем другой книги.
ПОПУЛЯРНОЕ
«18+» © 2001-2025 «Философия концептуального плюрализма». Все права защищены.
Администрация не ответственна за оценки и мнения сторонних авторов.
Администрация не ответственна за оценки и мнения сторонних авторов.

